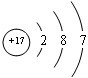
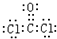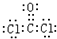解答:解:Ⅰ.若Fe
2O
3中含有FeO,利用稀酸(非氧化性)溶解后生成的亚铁离子,则具有还原性,而给出的试剂中KMnO
4溶液具有强氧化性,可使KMnO
4溶液褪色,
则选择试剂为稀硫酸、KMnO
4溶液;实验操作时的步骤、实验现象和结论为:取少量样品溶于试管中,配成溶液后,再滴入几滴稀硫酸和几滴KMnO
4溶液,只要溶液不褪色或不变浅,即说明样品中无FeO,
故答案为:KMnO
4溶液、稀硫酸;取少量样品溶于试管中,配成溶液后,再滴入几滴稀硫酸和几滴KMnO
4溶液,只要溶液不褪色或不变浅,即说明样品中无FeO;
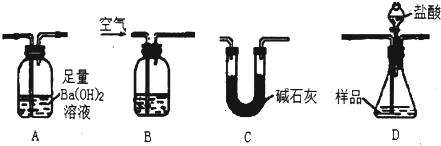
Ⅱ.(1)测定样品中Fe
2O
3的质量分数,先根据碳酸钙产生的二氧化碳的质量计算出碳酸钙的质量,再根据样品质量计算出氧化铁的质量分数,仪器连接顺序为:先将空气通入盛有氢氧化钠溶液的装置B,以便除去空气中的二氧化碳,然后利用空气将装置D中产生的二氧化碳驱赶到装置A,利用二氧化碳与氢氧化钡生成的碳酸钡沉淀的质量计算出碳酸钙的质量,由于空气中的二氧化碳、水蒸气影响测定结果,需要在装置A后连接一个吸收二氧化碳、水蒸气的装置C,所以装置连接顺序为:BDAC,
故答案为:BDAC;
(2)实验过程中需要持续通入空气,其作用除可以起到“搅拌”A、D中反应物达到充分反应外,还可以使反应生成的二氧化碳尽可能彻底的赶入装置A中,使反应生成的二氧化碳能够被氢氧化钡溶液完全吸收,
故答案为:将反应产生的CO
2气体尽可能彻底的赶入装置A中,使之完全被Ba(OH)
2溶液吸收;
(3)a、该实验是通过测定二氧化碳的质量来计算样品中氧化铁的质量分数的,在加入盐酸之前,应该排尽装置内的CO
2气体,避免装置中的二氧化碳影响测定结果,故a正确;
b、若加入的盐酸速度过快,二氧化碳与氢氧化钡溶液反应不完全,导致测定的二氧化碳的质量偏低,样品中碳酸钙的质量偏小,影响了测定结果,故b错误;
c、若装置B中装入浓硫酸,由于浓硫酸不能够吸收二氧化碳,导致空气中的二氧化碳被氢氧化钡溶液吸收,导致测定的二氧化碳质量偏大,应该使用氢氧化钠溶液,故c错误;
d、装置B中盛有氢氧化钠溶液,目的是为了吸收空气中的二氧化碳,避免空气中的二氧化碳影响测定结果,故d正确;
e、由于该实验是通过测定碳酸钡质量来计算生成二氧化碳的质量,二氧化碳中的氯化氢不影响测定结果,没有必要在D之后增添盛有饱和碳酸氢钠溶液的洗气装置,故e错误;
故选ad;
(4)由CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑、CO
2+Ba(OH)
2=BaCO
3↓+H
2O可知,CaCO
3~BaCO
3,
设碳酸钙的质量为x,
CaCO
3→BaCO
3,
100 197
x 19.7g
解得:x=10g,样品中氧化铁的质量为:26g-10g=16g,
样品中Fe
2O
3的质量分数为:
×100%=61.5%,
故答案为:61.5%;
(5)由于装置D生成的二氧化碳中混有氯化氢和水,导致装置A在吸收反应产生的气体前后的质量差偏大,测定的二氧化碳的质量偏大,碳酸钙的质量会偏大,样品中氧化铁的质量偏小,氧化铁的质量分数会偏低,
故答案为:偏低.



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案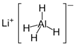 )、LiH是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al.下列说法不正确的是( )
)、LiH是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al.下列说法不正确的是( )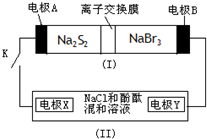 (2012?醴陵市模拟)如图所示,装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为电解池,装置(Ⅰ)的离子交换膜只允许Na+通过.电池充、放电的化学方程式为:
(2012?醴陵市模拟)如图所示,装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为电解池,装置(Ⅰ)的离子交换膜只允许Na+通过.电池充、放电的化学方程式为: