
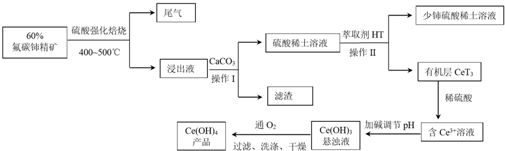
分析 (1)根据影响反应速率的因素可知,为增大反应速率,提高原料的利用率,焙烧前可将矿石粉碎成细颗粒处理;
(2)氟碳铈矿用硫酸强化焙烧得滤液中含有氟离子、铈离子、硫酸等,加入碳酸钙会生成硫酸钙和氟化钙等难溶物,据此答题;
(3)操作II为分液,分液需要的主要玻璃仪器有分液漏斗、烧杯、玻璃棒等;萃取的目的是将溶液中的Ce3+萃取出来,根据萃取剂的要求选择;
(4)根据平衡2Ce3+ (水层)+6HT(有机层)?2CeT3(有机层)+6H+(水层)可知,加入酸平衡向逆反应方程移动,据此分析;
(5)根据溶度积=c3(OH-)•c(Ce3+),结合pH=8及c(Ce3+)=b mol•L-1,可计算出a和b的关系;
(6)根据流程结合元素守恒可知Ce(OH)3结合氧气和水生成Ce(OH)4,据此书写化学方程式;
(7)根据电子得失守恒有关系式Ce(OH)4~FeSO4,根据FeSO4标准溶液中FeSO4的物质的量可计算出Ce(OH)4的质量,进而确定Ce(OH)4的质量分数;
解答 解:(1)根据影响反应速率的因素可知,为增大反应速率,提高原料的利用率,焙烧前可将矿石粉碎成细颗粒处理,
故答案为:粉碎成细颗粒;
(2)氟碳铈矿用硫酸强化焙烧得滤液中含有氟离子、铈离子、硫酸等,加入碳酸钙会生成硫酸钙和氟化钙等难溶物,所以操作I中滤渣的主要成分是CaF2、CaSO4,
故答案为:CaF2、CaSO4;
(3)操作II为分液,分液需要的主要玻璃仪器有分液漏斗、烧杯、玻璃棒等;萃取的目的是将溶液中的Ce3+萃取出来,根据萃取剂的要求选择可知,HT要不溶于水,也不和水反应、Ce3+不和萃取剂HT发生反应、Ce3+在萃取剂HT中溶解度大于水,故选①②③,
故答案为:分液漏斗;①②③;
(4)根据平衡2Ce3+ (水层)+6HT(有机层)?2CeT3(有机层)+6H+(水层)可知,混合液中加入H2SO4使c(H+)增大,平衡向形成Ge3+水溶液方向移动,
故答案为:混合液中加入H2SO4使c(H+)增大,平衡向形成Ge3+水溶液方向移动;
(5)根据题意,溶液中c(OH-)=10-6 mol•L-1,根据溶度积=c3(OH-)•c(Ce3+)可知a=(10-6)3•b,所以a=10-18b,
故答案为:a=10-18b;
(6)根据流程结合元素守恒可知Ce(OH)3结合氧气和水生成Ce(OH)4,反应的化学方程式为4Ce(OH)3+O2+2H2O=4Ce(OH)4,
故答案为:4Ce(OH)3+O2+2H2O=4Ce(OH)4;
(7)根据电子得失守恒有关系式Ce(OH)4~FeSO4,FeSO4标准溶液中FeSO4的物质的量为0.025×0.1mol=0.0025mol,所以Ce(OH)4的质量为0.0025mol×208g/mol=0.52g,则样品中Ce(OH)4的质量分数为$\frac{0.52}{0.545}$×100%=95%,
故答案为:95%.
点评 本题主要考查了影响化学反应速率的因素、物质的分离子操作、化学平衡的移动、氧化还原反应的书写及质量分数的计算,是对化学基础知识的综合考查,对学生综合应用基础知识的能力要求较高,答题时注意守恒的方法及平衡的思想的运用,题目难度中等.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
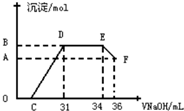 研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出.往反应结束后的溶液中,逐滴加入2mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列选项正确的是( )
研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出.往反应结束后的溶液中,逐滴加入2mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列选项正确的是( )| A. | 图中OC段的离子方程式为:NH4++OH-═NH3•H2O | |
| B. | 在DE段的离子方程式为:H++OH-═H2O | |
| C. | B与A的差值为 0.002mol | |
| D. | C点对应的氢氧化钠溶液的体积为7 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压32g O2 含2NA个原子 | |
| B. | 标准状况下11.2L H2O 含有的原子数目为1.5NA | |
| C. | 1mol的Cl- 含有NA个电子 | |
| D. | 0.5mol/L的NaCl 溶液中Cl-的个数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 | B. | NH3 | C. | CO2 | D. | FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
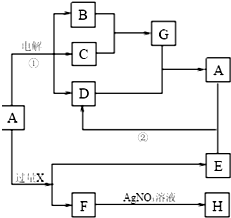 已知A是由两种中学常见元素组成的化合物,H、D为白色沉淀,E的焰色反应为黄色.A~H各物质之间的关系如图(反应中部分产物已略去,除气体间的反应物外,其余反应均在溶液中进行):
已知A是由两种中学常见元素组成的化合物,H、D为白色沉淀,E的焰色反应为黄色.A~H各物质之间的关系如图(反应中部分产物已略去,除气体间的反应物外,其余反应均在溶液中进行):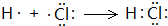 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
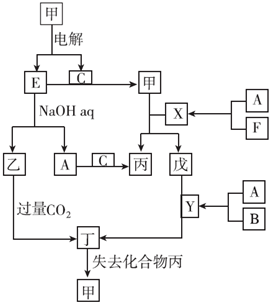
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com