
ЃЈ2012?КўФЯФЃФтЃЉввДМЪЧживЊЕФЛЏЙЄдСЯКЭвКЬхШМСЯЃЌПЩвддквЛЖЈЬѕМўЯТРћгУCO
2гыH
2ЗДгІжЦЕУЃК2CO
2ЃЈgЃЉ+6H
2ЃЈgЃЉ?CH
3CH
2OHЃЈgЃЉ+3H
2OЃЈgЃЉЁїHЃМ0
ЧыЛиД№ЃК
ЃЈ1ЃЉИУЗДгІЕФЛЏбЇЦНКтГЃЪ§БэДяЪНЮЊ
| c(CH3CH2OH)?c3(H2O) |
| c2(CO2)?c6(H2) |
| c(CH3CH2OH)?c3(H2O) |
| c2(CO2)?c6(H2) |
ЃЎ
ЃЈ2ЃЉЕБЮТЖШT
1ЃОT
2ЪБЃЌЛЏбЇЦНКтГЃЪ§K
1ЃМ
ЃМ
K
2ЃЈЬюЁАЃОЁБЁЂЁАЃМЁБЛђЁА=ЁБЃЉЃЎ
ЃЈ3ЃЉдкКуЮТЁЂКуШнЕФУмБеШнЦїжаЃЌЯТСаУшЪіФмЫЕУїЩЯЪіЗДгІвбДяЛЏбЇЦНКтзДЬЌЕФЪЧ
bd
bd
ЃЈЬюзжФИађКХЃЉЃЎ
aЃЎЩњГЩ1molCH
3CH
2OHЕФЭЌЪБЃЌЩњГЩ3mol H
2O
bЃЎШнЦїжаИїзщЗжЕФЮяжЪЕФСПХЈЖШВЛЫцЪБМфЖјБфЛЏ
cЃЎШнЦїжаЛьКЯЦјЬхЕФУмЖШВЛЫцЪБМфЖјБфЛЏ
dЃЎШнЦїжаЦјЬхЕФЗжзгзмЪ§ВЛЫцЪБМфЖјБфЛЏ
ЃЈ4ЃЉдкЙЄвЕЩњВњжаЃЌПЩЪЙH
2ЕФзЊЛЏТЪКЭЛЏбЇЗДгІЫйТЪЭЌЪБЬсИпЕФДыЪЉга
діДѓCO2ХЈЖШЛђдіДѓбЙЧП
діДѓCO2ХЈЖШЛђдіДѓбЙЧП
ЃЈаДГівЛЬѕКЯРэДыЪЉМДПЩЃЉЃЎ
ЃЈ5ЃЉЙЄвЕЩЯЃЌГЃвдввДМЮЊдСЯЩњВњввШЉЃЎИљОнШчЭМЫљЪОаХЯЂЃЌИУЗДгІЪЧЗДгІЃЈЬюЁАЗХШШЁБЛђЁАЮќШШЁБЃЉЃЌХаЖЯвРОнЪЧ
ЗДгІЮяЕФзмФмСПДѓгкЩњГЩЮяЕФзмФмСП
ЗДгІЮяЕФзмФмСПДѓгкЩњГЩЮяЕФзмФмСП
ЃЎ
ЃЈ6ЃЉввДМПЩвдзїЮЊШМСЯЕчГиЕФШМСЯЃЎФГввДМШМСЯЕчГивдввДМЮЊШМСЯЃЌЪЙгУЫсадЕчНтжЪЃЌИУЕчГиИКМЋЗДгІЕФЕчМЋЗДгІЪНЮЊ
CH3CH2OH-12e-+3H2O=2CO2+12H+
CH3CH2OH-12e-+3H2O=2CO2+12H+
ЃЎ

 ЃЈ2012?КўФЯФЃФтЃЉввДМЪЧживЊЕФЛЏЙЄдСЯКЭвКЬхШМСЯЃЌПЩвддквЛЖЈЬѕМўЯТРћгУCO2гыH2ЗДгІжЦЕУЃК2CO2ЃЈgЃЉ+6H2ЃЈgЃЉ?CH3CH2OHЃЈgЃЉ+3H2OЃЈgЃЉЁїHЃМ0
ЃЈ2012?КўФЯФЃФтЃЉввДМЪЧживЊЕФЛЏЙЄдСЯКЭвКЬхШМСЯЃЌПЩвддквЛЖЈЬѕМўЯТРћгУCO2гыH2ЗДгІжЦЕУЃК2CO2ЃЈgЃЉ+6H2ЃЈgЃЉ?CH3CH2OHЃЈgЃЉ+3H2OЃЈgЃЉЁїHЃМ0

 ПкЫуаФЫуЫйЫугІгУЬтЯЕСаД№АИ
ПкЫуаФЫуЫйЫугІгУЬтЯЕСаД№АИ ЭЌВНЭиеЙдФЖСЯЕСаД№АИ
ЭЌВНЭиеЙдФЖСЯЕСаД№АИ
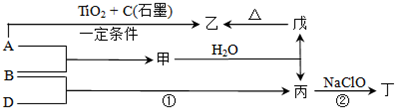
 ЃЈ2012?КўФЯФЃФтЃЉФћУЪЯЉЪЧвЛжжЪГгУЯуСЯЃЌЦфНсЙЙМђЪНШчЭМЫљЪОЃЎгаЙиФћУЪЯЉЕФЗжЮіе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ
ЃЈ2012?КўФЯФЃФтЃЉФћУЪЯЉЪЧвЛжжЪГгУЯуСЯЃЌЦфНсЙЙМђЪНШчЭМЫљЪОЃЎгаЙиФћУЪЯЉЕФЗжЮіе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ