
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。
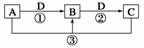
请回答下列问题:
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是__________;工业上制取A的离子方程式为______________________________________________________________________
________________________________________________________________________。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为________________________________________________________。
(3)若D是氯碱工业的主要产品之一,B有两性,则反应②的离子方程式是________________________________________________________________________
______________________________________________________ __________________。
__________________。
(4)若A、C、D都是常见气体,C是导致酸雨的主要气体,则反应③的化学方程式为________________________________________________________________________
________________________________________________________________________。
某同学将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,用离子方程式解释原因:________________________________________________________________________
________________________________________________________________________。
答案 (1)FeCl3 2Cl-+2H2O 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
(2)4NH3+5O2 4NO+6H2O
4NO+6H2O
(3)Al(OH)3+OH-===[Al(OH)4]-
(4)2H2S+SO2===3S↓+2H2O
2H2SO3+O2===4H++2SO
解析 (1)氯气常用于自来水消毒,则A为Cl2;铁是使用最广泛的金属单质,D是铁,则B为FeCl3,C是FeCl2。
(2)碱性气体为NH3,汽车尾气中遇空气会变色的气体是NO。
(3)常见的两性物质是Al2O3和Al(OH)3,D、C分别为NaOH和Na[Al(OH)4],故B为Al(OH)3。
(4)导致酸雨的主要气体是SO2,A与SO2均含有硫元素,且二者反应生成硫单质,故A为H2S。酸雨的主要成分是H2SO3,在放置过程中被氧化为H2SO4,酸性增强。


科目:高中化学 来源: 题型:
有机玻璃(PMMA)成分为聚甲基丙烯酸甲酯,因其透光性好、性能优良、价格低廉,广泛应用于商业,轻工、建筑、化工等方面,甚至人工角膜也是有机玻璃。其单体的结构和工业合成路线如图所示。
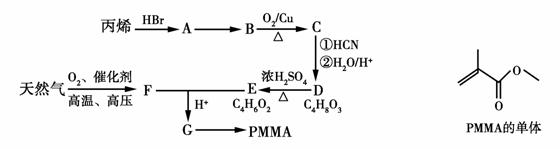
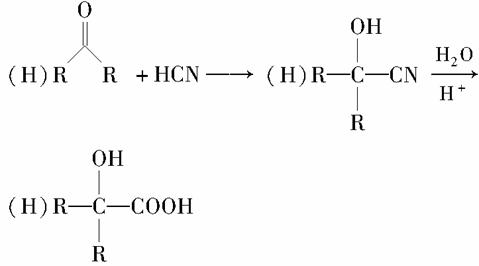
请回答下列问题:
(1)有机玻璃单体的分子式为________________。
(2)请指出反应类型:D→E属于________________反应,E+F→G属于________________反应。
(3)请指出A→B的反应条件:________________________。
(4)请写出B→C的化学方程式:______________________。
(5)写出同时符合下列条件的G的同分异构体的结构简式,请写出3种:__________________________________________________。
①能使溴水褪色;②能在碱性条件下水解;③能发生银镜反应;④具有支链。
(6)以苯乙酮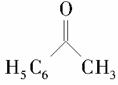 为主要原料合成
为主要原料合成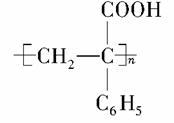 ,请设计合成路线(无机试剂任选),格式参照如下过程:CH3CHO
,请设计合成路线(无机试剂任选),格式参照如下过程:CH3CHO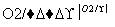 CH3COOH
CH3COOH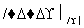 CH3COOCH2CH3。
CH3COOCH2CH3。
查看答案和解析>>
科目:高中化学 来源: 题型:
化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源。
(1)将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为C(s)+H2O(g)CO(g)+H2(g),该反应的化学平衡常数表达式为K=________。
若反应的逆反应速率与时间的关系如图所示:
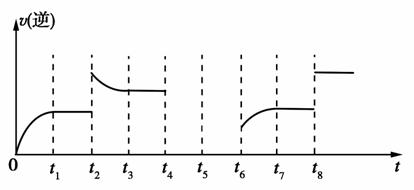
①可见反应在t1、t3、t7,时都达到了平衡,而t2、t8时都改变了一种条件,试判断t2时改变的是什么条件:t2时________________。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
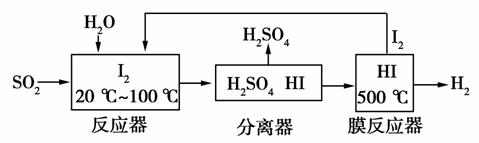
①用离子方程式表示反应器中发生的反应:________________。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4 mol·L-1和2 mol·L-1,取10 mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体的体积为(设反应中HNO3被还原成NO) ( )
A.0.448 L B.0.672 L
C.0.896 L D.0.224 L
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组同学设计如下图所示装置探究氨气的还原性。

(1)氨催化氧化的化学方程式为_____________________________________________
________________________________________________________________________。
(2)若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为__________。
(3)该小组同学以氨气和二氧化碳为原料制备碳酸氢铵。甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳。请选择合适的方案并说明原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
制备氮化镁的装置示意图如下:

回答下列问题:
(1)检查装置气密性的方法是________,a的名称是________,b的名称是________。
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式
________________________________________________________________________。
(3)C的作用是________,D的作用是________,是否可以把C与D的位置对调并说明理由________________________________________________________________________。
(4)写出E中发生反应的化学方程式________________________________________。
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
N2O俗称“笑气”,曾用作可吸入性麻醉剂。以下反应能产生N2O:3CO+2NO2 3CO2+N2O。下列关于N2O的说法正确的是 ( )
3CO2+N2O。下列关于N2O的说法正确的是 ( )
A .上述反应中每生成1 mol N2O,消耗1.5 mol CO
.上述反应中每生成1 mol N2O,消耗1.5 mol CO
B.等物质的量的N2O和CO2含有相等的电子数
C.N2O只具有氧化性,无还原性
D.N2O会迅速与人体血红蛋白结合,使人中毒
查看答案和解析>>
科目:高中化学 来源: 题型:
在含等物质的量浓度的Fe3+、NH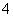 、H+、Al3+溶液中,逐滴滴加氢氧化钠溶液,生成物依次产生的顺序是( )
、H+、Al3+溶液中,逐滴滴加氢氧化钠溶液,生成物依次产生的顺序是( )
A.Fe(OH)3、H2O、Al(OH)3、NH3·H2O、NaAlO2
B.Al(OH)3、NH3、H2O、Fe(OH)3、NaAlO2、H2O
C.H2O、Fe(OH)3、Al(OH)3、NH3·H2O、NaAlO2
D.H2O、Fe(OH)3、Al(OH)3、NaAlO2、NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下有①0.112 L水 ②0.5NA个HCl分子
③25.6 g SO2气体 ④0.2 mol氨气 ⑤2 mol氦气 ⑥6.02×1023个白磷分子,所含原子个数从大到小的顺序为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com