
标准状况下有①0.112 L水 ②0.5NA个HCl分子
③25.6 g SO2气体 ④0.2 mol氨气 ⑤2 mol氦气 ⑥6.02×1023个白磷分子,所含原子个数从大到小的顺序为______________________。
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。
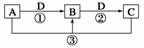
请回答下列问题:
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是__________;工业上制取A的离子方程式为______________________________________________________________________
________________________________________________________________________。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为________________________________________________________。
(3)若D是氯碱工业的主要产品之一,B有两性,则反应②的离子方程式是________________________________________________________________________
______________________________________________________ __________________。
__________________。
(4)若A、C、D都是常见气体,C是导致酸雨的主要气体,则反应③的化学方程式为________________________________________________________________________
________________________________________________________________________。
某同学将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,用离子方程式解释原因:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。

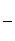

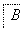
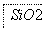
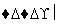

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的方法为:________________
(注明试剂、现象)。
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为________________(填代号)。
a.氢氧化钠溶液 b.硫酸溶液
c.氨水 d.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、________(填操作名称)、洗涤。
④该过程中涉及某氧化还原反应如下,请完成:
 Fe2++
Fe2++ ClO-+
ClO-+ __________===
__________=== Fe(OH)3↓+
Fe(OH)3↓+ Cl-+
Cl-+ ________
________
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为________(填代号)。
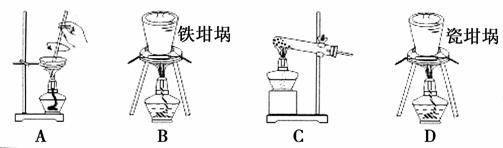
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示各物质之间的转化关系。已知D、E、Z是中学化学常见的单质,其他都是化合物。Z、Y是氯碱 工业的产品。D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂。E为日常生活中应用最广泛的金属。除反应①外,其他反应均在水溶液中进行。请回答下列问题。
工业的产品。D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂。E为日常生活中应用最广泛的金属。除反应①外,其他反应均在水溶液中进行。请回答下列问题。

(1)写出下列物质的化学式:B____________、G_____________________________、Y______________。
(2)在电镀工业中,若将E作为待镀金属,铜为镀层金属,则E是__________极,请写出在此电极上发生的电极反应式:
________________________________________________________________________。
(3)写出反应①的化学方程式______________________________________________。
(4)A溶液与NaOH溶液混合可形成沉淀,某温度下此沉淀的Ksp=2.097×10-39。将
0.01 mol·L-1的A溶液与0.001 mol·L-1的NaOH溶液等体积混合,你认为能否形成沉淀________(填“能”或“不能”),请通过计算说明___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的 金属,相关物质间的关系如下图所示。
金属,相关物质间的关系如下图所示。
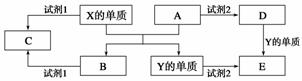
(1)X的单质与A反应的化学方程式是_______________________________________。
(2)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是 ________________________________________________________________
________________________________________________________________ ________。
________。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是_____________________________________
________________________________________________________________________。
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)________________________________________________________________________。
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
由阿伏加德罗常数(NA)和一个水分子的质量(m水)、一个水分子的体积(V水)不能确定的物理量是________。
①1摩尔水的质量 ②1摩尔水蒸气的质量 ③1摩尔水蒸气的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
N0为阿伏加德罗常数的值。下列叙述正确的是 ( )
A.1.0 L 1.0 mol·L-1的NaAlO2水溶液中含有的氧原子数为2N0
B.12 g石墨烯(单层石墨)中含有六元环的个数为0.5N0
C.25 ℃时pH=13的NaOH溶液中含有OH-的数目为0.1N0
D.1 mol的羟基与1 mol的氢氧根离子所含电子数均为9N0
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学设计如图所示的装置分别进行不同的探究实验(夹持装置已略去),请回答下列问题:

| 实验 | 药品 | 制取气体 | 量气管中液体 |
| Ⅰ | Cu、稀HNO3 | NO | H2O |
| Ⅱ | NaOH(s)、浓氨水 | NH3 | |
| Ⅲ | 电石、饱和NaCl溶液 | C2H2 | H2O |
| Ⅳ | 镁铝合金、NaOH溶液 | H2 | H2O |
(1)如何检验如图所示装置的气密性:________________________________________。
(2)该同学认为实验Ⅰ可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行?__________(填“可行”或“不可行”),原因是_______________________。
(3)实验Ⅲ烧瓶中发生反应的化学方程式是____________________________________,
打开开关K,产生的气体经验纯后点燃,现象是______________________________。
(4)实验Ⅱ中量气管中的液体最好是________(填字母编号,下同)。
a.浓NaOH溶液 b.氨水
c.煤油 d.饱和氯化铵溶液
该实验剩余的NH3需要吸收处理。以下各种尾气吸收装置中,适用于吸收NH3,而且能防止倒吸的有____________________________________________________________。


(5)本实验需对量气管进行多次读数,读数时应注意:①将实验装置恢复到室温,②__________________,③视线与凹液面最低处相平。
(6)实验Ⅳ获得以下数据(所有气体体积均已换算成标准状况下的体积,忽略滴入的液体体积对气体体积的影响):
| 编号 | 镁铝合金 质量 | 量气管 第一次读数 | 量气管 第二次读数 |
| ① | 1.0 g | 350.0 mL | 13.7 mL |
| ② | 1.0 g | 350.0 mL | 25.0 mL |
| ③ | 1.0 g | 350.0 mL | 14.3 mL |
根据表中数据,可计算出镁铝合金中铝的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
膳食纤维具有突出的保健功能,人体的“第七营养素”木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示。下列有关芥子醇的说法正确的是

| A.芥子醇的分子式是C11H14O4属于芳香烃 |
| B.芥子醇分子中所有碳原子不可能在同一平面 |
| C.芥子醇不能与FeCl3溶液发生显色反应 |
| D.芥子醇能发生的反应类型有氧化、取代、加成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com