
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。

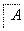

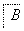
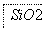

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的方法为:________________
(注明试剂、现象)。
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为________________(填代号)。
a.氢氧化钠溶液 b.硫酸溶液
c.氨水 d.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、________(填操作名称)、洗涤。
④该过程中涉及某氧化还原反应如下,请完成:
 Fe2++
Fe2++ ClO-+
ClO-+ __________===
__________=== Fe(OH)3↓+
Fe(OH)3↓+ Cl-+
Cl-+ ________
________
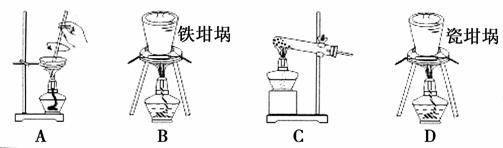
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为________(填代号)。
科目:高中化学 来源: 题型:
化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源。
(1)将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为C(s)+H2O(g)CO(g)+H2(g),该反应的化学平衡常数表达式为K=________。
若反应的逆反应速率与时间的关系如图所示:
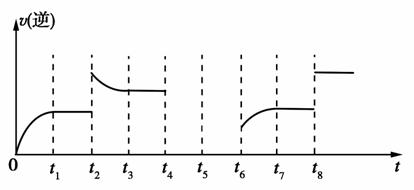
①可见反应在t1、t3、t7,时都达到了平衡,而t2、t8时都改变了一种条件,试判断t2时改变的是什么条件:t2时________________。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
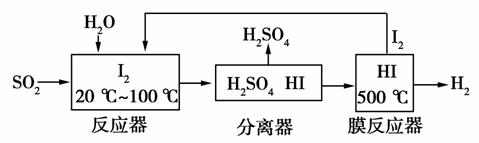
①用离子方程式表示反应器中发生的反应:________________。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
N2O俗称“笑气”,曾用作可吸入性麻醉剂。以下反应能产生N2O:3CO+2NO2 3CO2+N2O。下列关于N2O的说法正确的是 ( )
3CO2+N2O。下列关于N2O的说法正确的是 ( )
A .上述反应中每生成1 mol N2O,消耗1.5 mol CO
.上述反应中每生成1 mol N2O,消耗1.5 mol CO
B.等物质的量的N2O和CO2含有相等的电子数
C.N2O只具有氧化性,无还原性
D.N2O会迅速与人体血红蛋白结合,使人中毒
查看答案和解析>>
科目:高中化学 来源: 题型:
在含等物质的量浓度的Fe3+、NH 、H+、Al3+溶液中,逐滴滴加氢氧化钠溶液,生成物依次产生的顺序是( )
、H+、Al3+溶液中,逐滴滴加氢氧化钠溶液,生成物依次产生的顺序是( )
A.Fe(OH)3、H2O、Al(OH)3、NH3·H2O、NaAlO2
B.Al(OH)3、NH3、H2O、Fe(OH)3、NaAlO2、H2O
C.H2O、Fe(OH)3、Al(OH)3、NH3·H2O、NaAlO2
D.H2O、Fe(OH)3、Al(OH)3、NaAlO2、NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如图所示。

下列分析错误的是( )
A.AB段的反应为:Fe+2Fe3+===3Fe2+
B.第二份溶液中最终溶质为FeSO4
C.混合酸中NO 物质的量为0.4 mol
物质的量为0.4 mol
D.混合酸中H2SO4浓度为5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1 NaHSO4溶液:K+、Fe2+、NO3-、Cl-
B.0.1 mol·L-1NaAlO2的溶液:K+、Na+、SO42-、CO32-
C.无色溶液:Ba 2+、Na+、MnO4-、NO3-
D.由水电离出的c(OH-)=1.0×10-12 mol·L-1的溶液:NH4+、HCO3-、Na+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学—选修3物质结构与性质](15分)
X、Y、Z、W、R、T为前四周期元素且原子序数依次增大。T原子序数等于X、Y、R原子序数之和。Z为地壳中含量最多的元素。X、Z原子核外均有2个未成对电子。Z与R位于同一主族。X、Y、Z、W、R、T中只有两种金属元素,且存在下列反应:
2W+XZ2  X+2WZ
X+2WZ
回答下列问题:
(1)X、Y、Z的第一电离能最大的是 (用元素符号表示)。
(2)在元素R和元素Z形成的常见化合物中,属于非极性分子的是 (填化学式),该分子中中心原子以 杂化。
(3)由X、T元素组成的单质中一定不存在 (填序号)。
A、离子晶体 B、分子晶体 C、原子晶体 D、金属晶体
(4)基态T原子的核外电子排布式为 。
(5)T+能与NH3通过配位键结合为[T(NH3)n]+。该离子中T+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对。
① [T(NH3)n]+中n= 。
② [T(NH3)n]+中T+与n个氮原子构成的空间结构呈 型。
 (6)化合物WZ和NaCl的晶胞结构形似
(6)化合物WZ和NaCl的晶胞结构形似
(氯化钠晶胞结构如右图所示)。
①在WZ中,阳离子和阴离
子的配位数均为 。
②已知WZ的密度为a g/cm3,
则WZ中距离最近的阳离子间的距离为
pm(用含a的算式表示,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下有①0.112 L水 ②0.5NA个HCl分子
③25.6 g SO2气体 ④0.2 mol氨气 ⑤2 mol氦气 ⑥6.02×1023个白磷分子,所含原子个数从大到小的顺序为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于苯酚的叙述中,错误的是
A.其水溶液显强酸性,俗称石炭酸
B.其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗
C.其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶
D.碳酸氢钠溶液中滴入苯酚的水溶液后会放出二氧化碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com