
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如图所示。

下列分析错误的是( )
A.AB段的反应为:Fe+2Fe3+===3Fe2+
B.第二份溶液中最终溶质为FeSO4
C.混合酸中NO 物质的量为0.4 mol
物质的量为0.4 mol
D.混合酸中H2SO4浓度为5 mol·L-1
解析:本题考查了金属与酸的反应,意在考查考生对图像的分析能力以及计算能力。由图像可知,OA段发生反应Fe+4H++NO ===Fe3++NO↑+2H2O,AB段发生反应Fe+2Fe3+===3Fe2+,BC段发生反应Fe+2H+===Fe2++H2↑,反应中NO
===Fe3++NO↑+2H2O,AB段发生反应Fe+2Fe3+===3Fe2+,BC段发生反应Fe+2H+===Fe2++H2↑,反应中NO 全部参与反应,最终第二份溶液中的溶质是FeSO4,A、B选项正确;第一份溶液中NO
全部参与反应,最终第二份溶液中的溶质是FeSO4,A、B选项正确;第一份溶液中NO 全部参与反应,消耗铜的物质的量为
全部参与反应,消耗铜的物质的量为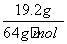 =0.3 mol,根据反应3Cu+8H++2NO
=0.3 mol,根据反应3Cu+8H++2NO ===3Cu2++2NO↑+4H2O可知,参与反应的HNO3为0.2 mol,所以混合酸中NO
===3Cu2++2NO↑+4H2O可知,参与反应的HNO3为0.2 mol,所以混合酸中NO 物质的量为0.4 mol,C选项正确;第二份溶液中n(SO
物质的量为0.4 mol,C选项正确;第二份溶液中n(SO )=n(Fe2+)=n(Fe)=
)=n(Fe2+)=n(Fe)=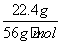 =0.4 mol,则混合酸中硫酸的浓度为
=0.4 mol,则混合酸中硫酸的浓度为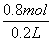 =4 mol·L-1,D选项错误。
=4 mol·L-1,D选项错误。
答案:D


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
已知(HF)2(g)2HF(g) ΔH>0,且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是( )

A.温度:T1<T2
B.平衡常数:K(a)=K(b)<K(c)
C.反应速率:vb>va
D.当 =30 g/mol时,n(HF):n[(HF)2]=2:1
=30 g/mol时,n(HF):n[(HF)2]=2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是 ( )
A.豆科植物通过根瘤菌吸收空气中的氮气,属于化学变化
B.汽车尾气中排放的氮氧化合物主要是由游离态氮转化来的
C.化石燃料燃烧通常不释放出氮氧化合物
D.植物秸秆燃烧时放出氮氧化合物,参与了氮的循环
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是( )
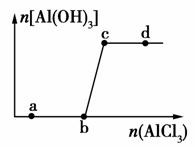
A.a点对应的溶液中:Na+、Fe3+、SO 、HCO
、HCO
B.b点对应的溶液中:Ag+、Ca2+、NO 、F-
、F-
C.c点对应的溶液中:Na+、S2-、SO 、Cl-
、Cl-
D.d点对应的溶液中:K+、NH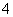 、I-、CO
、I-、CO
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的性质与应用不相对应的是( )
A.铁的金属活泼性强,故不能用钢瓶来盛放液氯
B.Na2O2与CO2能反应产生氧气,用作呼吸面具和潜水艇供氧剂
C.NaHCO3受热能分解产生CO2气体,在食品工业中可作为焙制糕点的膨松剂
D.常温下浓硫酸能使铝发生钝化,常温下可用铝制容器贮藏贮运浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。

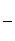
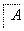
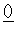

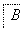
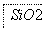
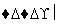

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的方法为:________________
(注明试剂、现象)。
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为________________(填代号)。
a.氢氧化钠溶液 b.硫酸溶液
c.氨水 d.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、________(填操作名称)、洗涤。
④该过程中涉及某氧化还原反应如下,请完成:
 Fe2++
Fe2++ ClO-+
ClO-+ __________===
__________=== Fe(OH)3↓+
Fe(OH)3↓+ Cl-+
Cl-+ ________
________
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为________(填代号)。
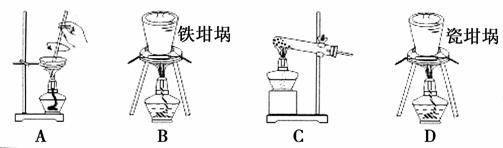
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.已知2SO2(g)+ O2(g) 2SO3 (g) △H<0,该反应在任何温度下均可自发进行
2SO3 (g) △H<0,该反应在任何温度下均可自发进行
B.0.01 mol·L-1NaHCO3溶液中c(Na+)= c(HCO3 -)+ 2c(CO32-)+ c(H2CO3)
C.25℃,0.1mol·L-1 K2CO3溶液中c(H+)/ c(OH-) =l.0 × l0-a,该溶液的pH=7+0.5a
D.室温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12,向浓度相等的Na2CrO4和NaCl的混合稀溶液中滴加0.01 mol·L-1 AgNO3溶液,先生成Ag2CrO4沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的 金属,相关物质间的关系如下图所示。
金属,相关物质间的关系如下图所示。
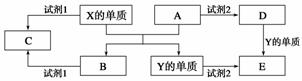
(1)X的单质与A反应的化学方程式是_______________________________________。
(2)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是 ________________________________________________________________
________________________________________________________________ ________。
________。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是_____________________________________
________________________________________________________________________。
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)________________________________________________________________________。
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com