
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是( )
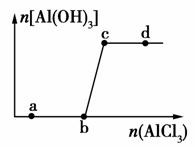
A.a点对应的溶液中:Na+、Fe3+、SO 、HCO
、HCO
B.b点对应的溶液中:Ag+、Ca2+、NO 、F-
、F-
C.c点对应的溶液中:Na+、S2-、SO 、Cl-
、Cl-
D.d点对应的溶液中:K+、NH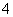 、I-、CO
、I-、CO
科目:高中化学 来源: 题型:
500 ℃、20 MPa时,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示(10 min时达到第一次平衡),下列说法正确的是( ) 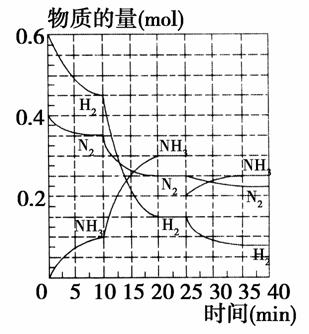
A.反应开始到第一次平衡时,N2的平均反应速率为0.005 mol/(L·min)
B.从曲线可以看出,反应进行到10 min至20 min时可能是使用了催化剂
C.从曲线可以看出,反应进行至25 min时,增加了0.1 mol的氨气
D.在25 min时平衡正向移动但达到新平衡后NH3的体积分数比原平衡小
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组同学设计如下图所示装置探究氨气的还原性。

(1)氨催化氧化的化学方程式为_____________________________________________
________________________________________________________________________。
(2)若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为__________。
(3)该小组同学以氨气和二氧化碳为原料制备碳酸氢铵。甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳。请选择合适的方案并说明原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
N2O俗称“笑气”,曾用作可吸入性麻醉剂。以下反应能产生N2O:3CO+2NO2 3CO2+N2O。下列关于N2O的说法正确的是 ( )
3CO2+N2O。下列关于N2O的说法正确的是 ( )
A .上述反应中每生成1 mol N2O,消耗1.5 mol CO
.上述反应中每生成1 mol N2O,消耗1.5 mol CO
B.等物质的量的N2O和CO2含有相等的电子数
C.N2O只具有氧化性,无还原性
D.N2O会迅速与人体血红蛋白结合,使人中毒
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学课外活动小组在实验室设计了如图所示的实验装置,进行“氨的催化氧化”实验。

(1)A处是气体发生装置,A中所用的试剂只能从下列物质中选取:
①硝酸铵;②碳酸铵;③碳酸氢铵;④氯化铵;⑤熟石灰;⑥氢氧化钠。
若A中制取气体时只用了一种药品,则该药品可以是__________(填选项编号),在只用一种药品制取氨气时,图中空白处所需仪器应为____________(选填下列仪器编号,固定装置省略)。


(2)该装置补充完整后,仍然存在一定的缺陷,试从安全与环保的角度来考虑,对该装置进行改进:
①________________________________________________________________________;
②________________________________________________________________________。
(3)按照改进后的装置进行实验,请完成以下问题:
①装置B的作用是_____________________________________________________;
②写出C中发生反应的化学方程式:_______________________________________;
③若A、B处试剂足量,则装置D中可以观察到的实验现象有________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在含等物质的量浓度的Fe3+、NH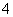 、H+、Al3+溶液中,逐滴滴加氢氧化钠溶液,生成物依次产生的顺序是( )
、H+、Al3+溶液中,逐滴滴加氢氧化钠溶液,生成物依次产生的顺序是( )
A.Fe(OH)3、H2O、Al(OH)3、NH3·H2O、NaAlO2
B.Al(OH)3、NH3、H2O、Fe(OH)3、NaAlO2、H2O
C.H2O、Fe(OH)3、Al(OH)3、NH3·H2O、NaAlO2
D.H2O、Fe(OH)3、Al(OH)3、NaAlO2、NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如图所示。

下列分析错误的是( )
A.AB段的反应为:Fe+2Fe3+===3Fe2+
B.第二份溶液中最终溶质为FeSO4
C.混合酸中NO 物质的量为0.4 mol
物质的量为0.4 mol
D.混合酸中H2SO4浓度为5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学—选修3物质结构与性质](15分)
X、Y、Z、W、R、T为前四周期元素且原子序数依次增大。T原子序数等于X、Y、R原子序数之和。Z为地壳中含量最多的元素。X、Z原子核外均有2个未成对电子。Z与R位于同一主族。X、Y、Z、W、R、T中只有两种金属元素,且存在下列反应:
2W+XZ2  X+2WZ
X+2WZ
回答下列问题:
(1)X、Y、Z的第一电离能最大的是 (用元素符号表示)。
(2)在元素R和元素Z形成的常见化合物中,属于非极性分子的是 (填化学式),该分子中中心原子以 杂化。
(3)由X、T元素组成的单质中一定不存在 (填序号)。
A、离子晶体 B、分子晶体 C、原子晶体 D、金属晶体
(4)基态T原子的核外电子排布式为 。
(5)T+能与NH3通过配位键结合为[T(NH3)n]+。该离子中T+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对。
① [T(NH3)n]+中n= 。
② [T(NH3)n]+中T+与n个氮原子构成的空间结构呈 型。
 (6)化合物WZ和NaCl的晶胞结构形似
(6)化合物WZ和NaCl的晶胞结构形似
(氯化钠晶胞结构如右图所示)。
①在WZ中,阳离子和阴离
子的配位数均为 。
②已知WZ的密度为a g/cm3,
则WZ中距离最近的阳离子间的距离为
pm(用含a的算式表示,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿伏加德罗常数的值。下列有关叙述正确的是 ( )
A.分子数为NA的CO、C2H4混合气体的体积约为22.4 L,质量为28 g
B.常温下,1 L 0.1 mol·L-1的NH4NO3溶液中NH 和NO
和NO 的总数为0.2NA
的总数为0.2NA
C.标准状况下,4.48 L重水(D2O)中含有的中子数为2NA
D.1 mol甲基(—CH3)所含的电子数为9NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com