
[化学—选修3物质结构与性质](15分)
X、Y、Z、W、R、T为前四周期元素且原子序数依次增大。T原子序数等于X、Y、R原子序数之和。Z为地壳中含量最多的元素。X、Z原子核外均有2个未成对电子。Z与R位于同一主族。X、Y、Z、W、R、T中只有两种金属元素,且存在下列反应:
2W+XZ2  X+2WZ
X+2WZ
回答下列问题:
(1)X、Y、Z的第一电离能最大的是 (用元素符号表示)。
(2)在元素R和元素Z形成的常见化合物中,属于非极性分子的是 (填化学式),该分子中中心原子以 杂化。
(3)由X、T元素组成的单质中一定不存在 (填序号)。
A、离子晶体 B、分子晶体 C、原子晶体 D、金属晶体
(4)基态T原子的核外电子排布式为 。
(5)T+能与NH3通过配位键结合为[T(NH3)n]+。该离子中T+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对。
① [T(NH3)n]+中n= 。
② [T(NH3)n]+中T+与n个氮原子构成的空间结构呈 型。
 (6)化合物WZ和NaCl的晶胞结构形似
(6)化合物WZ和NaCl的晶胞结构形似
(氯化钠晶胞结构如右图所示)。
①在WZ中,阳离子和阴离
子的配位数均为 。
②已知WZ的密度为a g/cm3,
则WZ中距离最近的阳离子间的距离为
pm(用含a的算式表示,阿伏伽德罗常数为NA)。
科目:高中化学 来源: 题型:
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是( )
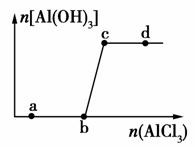
A.a点对应的溶液中:Na+、Fe3+、SO 、HCO
、HCO
B.b点对应的溶液中:Ag+、Ca2+、NO 、F-
、F-
C.c点对应的溶液中:Na+、S2-、SO 、Cl-
、Cl-
D.d点对应的溶液中:K+、NH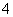 、I-、CO
、I-、CO
查看答案和解析>>
科目:高中化学 来源: 题型:
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。

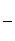
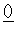

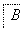
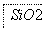

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的方法为:________________
(注明试剂、现象)。
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为________________(填代号)。
a.氢氧化钠溶液 b.硫酸溶液
c.氨水 d.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、________(填操作名称)、洗涤。
④该过程中涉及某氧化还原反应如下,请完成:
 Fe2++
Fe2++ ClO-+
ClO-+ __________===
__________=== Fe(OH)3↓+
Fe(OH)3↓+ Cl-+
Cl-+ ________
________
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为________(填代号)。
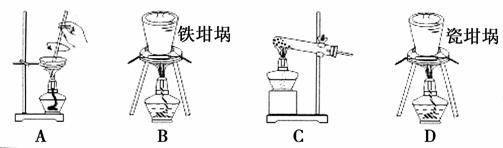
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.已知2SO2(g)+ O2(g) 2SO3 (g) △H<0,该反应在任何温度下均可自发进行
2SO3 (g) △H<0,该反应在任何温度下均可自发进行
B.0.01 mol·L-1NaHCO3溶液中c(Na+)= c(HCO3 -)+ 2c(CO32-)+ c(H2CO3)
C.25℃,0.1mol·L-1 K2CO3溶液中c(H+)/ c(OH-) =l.0 × l0-a,该溶液的pH=7+0.5a
D.室温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12,向浓度相等的Na2CrO4和NaCl的混合稀溶液中滴加0.01 mol·L-1 AgNO3溶液,先生成Ag2CrO4沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示各物质之间的转化关系。已知D、E、Z是中学化学常见的单质,其他都是化合物。Z、Y是氯碱 工业的产品。D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂。E为日常生活中应用最广泛的金属。除反应①外,其他反应均在水溶液中进行。请回答下列问题。
工业的产品。D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂。E为日常生活中应用最广泛的金属。除反应①外,其他反应均在水溶液中进行。请回答下列问题。

(1)写出下列物质的化学式:B____________、G_____________________________、Y______________。
(2)在电镀工业中,若将E作为待镀金属,铜为镀层金属,则E是__________极,请写出在此电极上发生的电极反应式:
________________________________________________________________________。
(3)写出反应①的化学方程式______________________________________________。
(4)A溶液与NaOH溶液混合可形成沉淀,某温度下此沉淀的Ksp=2.097×10-39。将
0.01 mol·L-1的A溶液与0.001 mol·L-1的NaOH溶液等体积混合,你认为能否形成沉淀________(填“能”或“不能”),请通过计算说明___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的 金属,相关物质间的关系如下图所示。
金属,相关物质间的关系如下图所示。
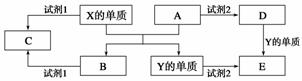
(1)X的单质与A反应的化学方程式是_______________________________________。
(2)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是 ________________________________________________________________
________________________________________________________________ ________。
________。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是_____________________________________
________________________________________________________________________。
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)________________________________________________________________________。
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
N0为阿伏加德罗常数的值。下列叙述正确的是 ( )
A.1.0 L 1.0 mol·L-1的NaAlO2水溶液中含有的氧原子数为2N0
B.12 g石墨烯(单层石墨)中含有六元环的个数为0.5N0
C.25 ℃时pH=13的NaOH溶液中含有OH-的数目为0.1N0
D.1 mol的羟基与1 mol的氢氧根离子所含电子数均为9N0
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式错误的是
A.Fe(OH)2溶液中加入HNO3溶液:Fe(OH)2+2H+=2H2O+Fe2+
B.盐酸除去铜器表面的铜绿:Cu2(OH)2CO3+4H+=3H2O+2Cu2++CO2↑
C.氯气可以降低的SO2的漂白性:SO2+Cl2+2H2O=2Cl—+4H++SO42—
D.CO2通入饱和碳酸钠溶液:CO2+ CO32—+2Na++H2O=2NaHCO3↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com