
【题目】用双线桥表示下列反应的电子转移方向和数目:
①Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O__________
②3Cl2+6KOH===5KCl+KClO3+3H2O_________
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】一种三层(熔)液电解辉锑矿(Sb2S3,半导体)制取锑的装置如图所示。 下列说法错误的是( )
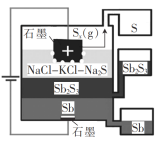
A.Sb在阴极生成
B.三层流体互不相溶,密度也不同
C.阳极的电极反应式为xS2- - 2xe- = Sx
D.该电解工艺可在室温下工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,铁的氯化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)在实验室中,FeCl2可用铁粉和___(填名称)反应制备。
(2)Fe3O4可用多种方法制得,其中由一种单质和一种化合物通过化合反应制备的化学方程式为___。
(3)实验室在制备Fe(OH)2时必须隔绝空气,否则发生的现象是___,对应的化学方程式为___。
(4)红砖是用黏土高温烧结而成的,因其含有Fe2O3呈红色或棕红色而得名,常用作建筑材料。请设计一个简单实验证明红砖中含有Fe3+:___。
(5)现有一含有FeCl2和FeCl3的混合物样品,实验测得n(Fe):n(C1)=1:2.1,则该样品中FeCl3的物质的量分数为___。
(6)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知3CuO+2NH3![]() 3Cu+N2+3H2O。下列判断正确的是
3Cu+N2+3H2O。下列判断正确的是
A.N元素的化合价降低B.NH3被还原
C.消耗0.3 mol CuO转移0.6 NA个电子D.CuO是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有七种元素,其中A、X、Y、D、E为短周期主族元素,Z、G为第四周期元素,它们的原子序数依次增大。请回答问题。
A | 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
X | 元素原子的核外 |
Y | 原子的第一至第四电离能分别是: |
D | 原子核外所有 |
E | 元素的主族序数与周期数的差为4 |
Z | 是前四周期中电负性最小的元素 |
G | 在周期表的第七列 |
(1)已知![]() 为离子化合物,写出其电子式_______________。
为离子化合物,写出其电子式_______________。
(2)X基态原子中能量最高的电子,其电子云在空间有______个方向,原子轨道呈_____形;![]() 的空间构型为__________。
的空间构型为__________。
(3)某同学根据上述信息,推断Y基态原子的核外电子排布为:
![]()
该同学所画的电子排布图违背了________________________。
(4)G位于元素周期表的_________区,原子结构示意图为____________________。
(5)![]() 中心原子的杂化方式为_________,其空间构型为____________________。
中心原子的杂化方式为_________,其空间构型为____________________。
(6)Z元素的基态原子价电子排布式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%,写出CO2溶于水产生HCO3-的方程式:_____________。
(2)在海洋循环中,通过如图所示的途径固碳。
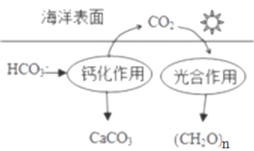
①写出钙化作用的离子方程式:_____________。
②同位素示踪法证实光合作用释放出的O2只来自于H2O,用18O标记物质的光合作用的化学方程式如下,将其补充完整:_____________+_____________=(CH2O)x+x18O2+xH2O,_____________
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①气提、吸收CO2,用N2从酸化后的海水中吹出CO2并用碱液吸收(装置示意图如图所示),将虚线框中的装置补充完整并标出所用试剂。_____________

②滴定。将吸收液洗后的无机碳转化为NaHCO3,再用xmol/LHCl溶液滴定,消耗ymLHCl溶液,海水中溶解无机碳的浓度=_____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W.X、Y和Z在周期表中的相对位置如表所示,X原子的最外层电子数与电子层数相同。下列关系正确的是( )
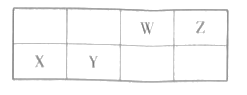
A.简单离子半径:X>W>Z
B.最高价氧化物对应水化物的酸性:Y>W
C.X.Y分别与2形成的二元化合物中化学键相同
D.工业上可用电解熔融的X2Z3制备X单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去KCl固体中少量的MgCl2、MgSO4,可选用Ba(OH)2、盐酸和K2CO3三种试剂,按如下步骤操作:

(1)图中三种试剂分别为:A___________、B___________、C____________.
(2)①加入过量A的目的是___________________________;
②加入过量B的目的是_____________________________;
③加热煮沸的目的是_______________________________;
④操作Ⅰ和操作Ⅱ的名称分别是_______、_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com