
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. |  | ||
| C. |  | D. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ |
科目:高中化学 来源:2017届湖北省高三联合考试化学试卷(解析版) 题型:选择题
下列各组物质中,常温下Y既能与X反应又能与Z反应的是
选项 | X | Y | Z |
A | SO2 | NaClO溶液 | CO2 |
B | 盐酸 | 浓硫酸 | Cu |
C | NH3 | O2 | Mg |
D | Na2O2 | H2O | SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ${\;}_{2}^{3}$He核聚变是化学变化 | |
| B. | ${\;}_{2}^{3}$He和42He互为同素异形体 | |
| C. | ${\;}_{2}^{3}$He原子核内含仅含有1个中子 | |
| D. | ${\;}_{2}^{4}$He的最外层电子数为2,所以易失电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
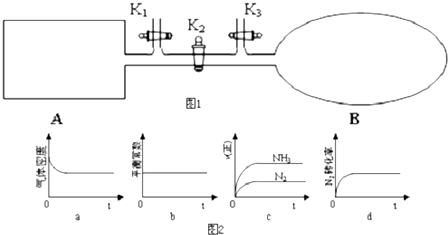
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,参加反应的HCl的物质的量为0.2mol,其中被氧化的HCl的质量3.65g.
,参加反应的HCl的物质的量为0.2mol,其中被氧化的HCl的质量3.65g.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol•L-1CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)═0.1 mol•L-1 | |
| B. | 25℃时,等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(C6H5ONa)>pH(NaHCO3)>pH(CH3COONa) | |
| C. | 25℃时,pH=9.4,浓度均为0.1 mol•L-1的HCN与NaCN的混合溶液中:c(Na+)>c(HCN)>c(CN-)>c(OH-) | |
| D. | 将足量AgCl分别放入:①5m水,②10mL0.2mol/LMgC12,③20mL0.3mol/L盐酸中溶解至饱和,c(Ag+):①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
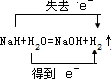 ,若该反应生成标况下氢气11.2L,则此时反应转移的电子数目是0.5NA.
,若该反应生成标况下氢气11.2L,则此时反应转移的电子数目是0.5NA.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
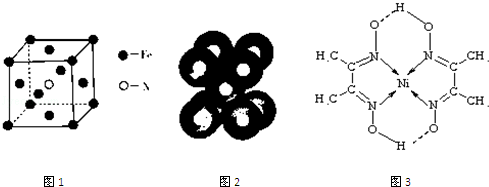
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com