
| A. | 2 mol•L-1 | B. | 0.2 mol•L-1 | C. | 0.02mol•L-1 | D. | 20 mol•L-1 |
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
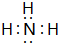 .e3z与盐酸反应生成2种盐,其中热稳定性最差的生成盐的电子式为
.e3z与盐酸反应生成2种盐,其中热稳定性最差的生成盐的电子式为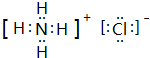 .
.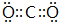 .z单质的电子式为
.z单质的电子式为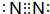 ,其结构式为N≡N.e和d形成原子个数为1:1的化合物的电子式为
,其结构式为N≡N.e和d形成原子个数为1:1的化合物的电子式为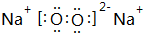 .用电子式表示x和d原子个数为1:1的化合物的形成过程
.用电子式表示x和d原子个数为1:1的化合物的形成过程 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 | ①将一小块金属钠放入滴有酚酞溶液的冷水中 ②将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液. ③将一小段镁带投入稀盐酸中 ④将一小片铝投入稀盐酸中 |
| 实验 现象 | ①剧烈反应,迅速生成大量的气体. ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红. ③反应不剧烈,产生无色气体. ④有气体产生,溶液变成红色. |
| 实验 | 1 | 2 | 3 | 4 |
| 实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 变质的油脂有特殊难闻气味,是因为油脂发生了氧化反应 | |
| B. | 棉花的主要成分是淀粉 | |
| C. | 酒精类饮料中含有乙醇 | |
| D. | 牛奶中含有蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1 L苯所含有的分子数为$\frac{{N}_{A}}{22.4}$ | |
| B. | 1 mol甲基(-CH3)所含电子数为9NA | |
| C. | 标准状况下,22.4 LC2H4的质量为28克 | |
| D. | 26 g C2H2和苯蒸气的混合气体中所含的C原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1.12L CCl4含有Cl原子数目为0.4 NA | |
| B. | 17g OH-所含电子数为9NA | |
| C. | 39g Na2O2与足量H2O反应,转移电子数为NA | |
| D. | 常温常压下,CO2与N2O的混合气体共44 g,其中含有的原子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ①③④ | C. | ②④⑥ | D. | ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅠA族元素也称为碱金属元素 | |
| B. | 稀有气体元素原子的最外层电子数均为8 | |
| C. | 元素周期表中最右上角元素的非金属性最强 | |
| D. | 元素周期表有18个纵行,16个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氘(D)的原子核外有2个电子 | |
| B. | 1H与D是同一种原子 | |
| C. | H2O与D2O互称同素异形体 | |
| D. | 1H${\;}_{2}^{18}$O与D${\;}_{2}^{16}$O的相对分子质量相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com