
【题目】阿伏加德罗常数的值为 NA,下列说法正确的是( )
A. 阿伏加德罗常数就是6.02×1023
B. 含有阿伏加德罗常数个粒子的物质的量是1mol
C. 1molNH3所含原子数约是2.408×1023
D. 标准状况下,2.24LSO3分子数为0.1NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】秋葵是一种大众喜爱的食材,含有蛋白质、维生素A、维生素C、纤维素、阿拉伯果糖和丰富的铁、锌、钙等元素,其中属于糖类的有( )
A. 维生素A和维生素C
B. 蛋白质和维生素A和维生素C
C. 纤维素和阿拉伯果糖
D. 阿拉伯果糖 和铁、锌、钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示: 
(1)该反应的化学方程式为 .
(2)从反应开始到10s时,用Y表示的反应速率为 , X的转化率为 . (保留三位有效数字)
(3)10s时,该反应达到了化学平衡状态.(填“是”或“否”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6mol A 气体和3mol B气体置于3L的密闭容器中,混合后发生如下反应:2A(g)+B(g)═2C(g).若经2s后测得B的浓度为0.4mol/L,下列说法正确的是( )
A.用物质A表示的反应速率为0.4mol/(Ls)
B.用物质B表示的反应速率为0.4mol/(Ls)
C.2 s时物质B的转化率为40%
D.2 s时物质C的浓度为1.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往2L密闭容器中充入NO2,在三种不同条件下发生反应2NO2(g) ![]() 2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(不考虑生成N2O4)
2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(不考虑生成N2O4)
浓度/mol/L | 0 | 10 | 20 | 30 | 40 | 50 |
实验1/800℃ | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
实验2/800℃ | 1.00 | 0.70 | 0.50 | 0.50 | 0.50 | 0.50 |
实验3/850℃ | 1.00 | 0.50 | 0.40 | 0.15 | 0.15 | 0.15 |
下列说法正确的是
A. 实验2使用了比实验1效率更高的催化剂
B. 实验2的反应容器体积比实验1的小
C. 通过实验2和实验3可判断该反应是放热反应
D. 实验2的平衡常数比实验3的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把 0.6molX气体和0.4molY气体混合于2L的密闭容器中,使它们发生如下反应 3X(g)+Y(g)nZ(g)+2W(g),5min末已生成 0.2molW,若测知以 Z 表示的平均反应速率为 0.01molL﹣1min﹣1 , 则 n是( )
A.2
B.4
C.1
D.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中反应制得:①3SiO2+6C+2N2![]() Si3N4+6CO;也可由SiCl4的蒸汽和NH3反应制取:②3SiCl4+4NH3
Si3N4+6CO;也可由SiCl4的蒸汽和NH3反应制取:②3SiCl4+4NH3![]() Si3N4+12HCl。则下列叙述正确的是
Si3N4+12HCl。则下列叙述正确的是
A. 反应②属于离子反应
B. 若制取等量的Si3N4,则反应①②转移电子数目必然相等
C. 反应①的氧化剂是N2
D. 反应①中氧化产物与还原产物物质的量之比为1∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
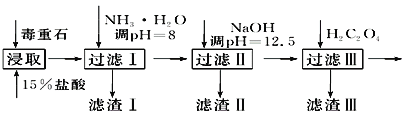
(1)毒重石用盐酸浸取前需充分研磨,目的是_______________________________________;实验室用37%的盐酸配制15%的盐酸,除量筒外还需使用下列仪器中的________。
a.烧杯 b.一定容积的容量瓶 c.玻璃棒 d.滴定管
(2)查阅有关资料获得沉淀各种杂质离子的pH见下表:
沉淀杂质离子 | Ca2+ | Mg2+ | Fe3+ |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
加入NH3·H2O调节pH=8可除去______(填离子符号);滤渣Ⅱ中含__________(填化学式)。加入H2C2O4时应避免过量,原因是_____________________(已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9)。
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。已知:2CrO![]() +2H+===Cr2O
+2H+===Cr2O![]() +H2O Ba2++CrO
+H2O Ba2++CrO![]() ===BaCrO4↓
===BaCrO4↓
步骤Ⅰ.准确移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入几滴酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。
步骤Ⅱ.准确移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ 相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的________(选填“上方”或“下方”)。BaCl2溶液的浓度为________________mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,则所测得Ba2+浓度测量值将________(选填“偏大”或“偏小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com