
| A. | NO2溶于水:3NO2+H2O=H++NO3-+2NO | |
| B. | NaClO溶液中ClO-的水解:ClO-+H2O=HClO+OH- | |
| C. | 酸性条件下,用H2O2将I-转化为I2:H2O2+2I-+2H+=I2+2H2O | |
| D. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O |
分析 A.原子个数不守恒;
B.次氯酸根离子水解为可逆反应;
C.过氧化氢氧化碘离子生成单质碘;
D.不符合反应客观事实.
解答 解:A.NO2溶于水,离子方程式:3NO2+H2O=2H++2NO3-+2NO,故A错误;
B.NaClO溶液中ClO-的水解,离子方程式:ClO-+H2O?HClO+OH-,故B错误;
C.酸性条件下,用H2O2将I-转化为I2,离子方程式:H2O2+2I-+2H+=I2+2H2O,故C正确;
D.氯化铝的溶液中加入过量氨水的离子反应为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选:C.
点评 本题离子方程式的书写,明确发生的反应是解答本题的关键,注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心就是治理工业生产对环境产生的污染 | |
| B. | 铁、钙、碘都是人体必不可少的微量元素 | |
| C. | 食盐可作调味剂,但不可作食品防腐剂 | |
| D. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素H只有${\;}_1^1$H和${\;}_1^2$H两种核素 | |
| B. | Cl2、NH4Cl中氯元素微粒的半径:r(Cl)>r(Cl-) | |
| C. | 工业上常用干燥的钢瓶储存液氯,是因为铁和氯气在任何条件下都不反应 | |
| D. | 该反应表明常温下氯气有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
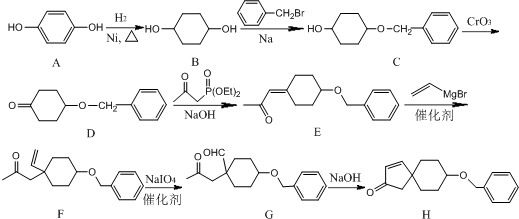
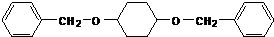 ;由C→D的反应类型是氧化反应.
;由C→D的反应类型是氧化反应.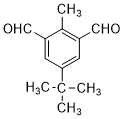 或
或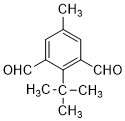 .
. 为有机原料制备
为有机原料制备 的合成路线流程图(无机试剂任选,可选择适当有机溶剂).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选,可选择适当有机溶剂).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com