
分析 依据化学平衡三段式列式计算,
(1)依据c=$\frac{n}{V}$计算浓度;
(2)反应速率v=$\frac{△c}{△t}$计算得到1min内的反应速率;
(3)依据化学平衡三段式列式计算转化率=$\frac{消耗量}{起始量}$×100%.
解答 解:在1L容器中
A(g)+2B(g)?c(g).
起始量(mol) 1mol 1.2mol 0
变化量(mol) (1-0.6)mol (1-0.6)×2mol (1-0.6)mol
1min后量(mol)0.6mol/L×1L=0.6mol 0.4mol 0.4mol
(1)1min末B的浓度c=$\frac{n}{V}$=$\frac{0.4mol}{1L}$=0.4mol/L
1min末C的浓度c=$\frac{n}{V}$=$\frac{0.4mol}{1L}$=0.4mol/L
答:1min末B、C的浓度分别为0.4mol/L、0.4mol/L;
(2)1min内的反应速率v=$\frac{△c}{△t}$=$\frac{(1-0.6)mol}{\frac{1L}{1min}}$=0.4mol/(L•min),
答:以A表示该反应的在1min内的反应速率为0.4mol/(L•min);
(3)B 的转化率$\frac{消耗量}{起始量}$×100%=$\frac{(1-0.6)×2mol}{1.2mol}$×100%≈66.7%,
答:B的转化率66.7%.
点评 本题考查了化学平衡的三段式计算应用,转化率、反应速率概念的计算分析是解题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
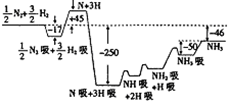 2007年度诺贝尔化学奖获得者格哈德•埃特尔建立了合成氨反应机理,T=673K时,各步反应的能量变化如图所示,图中的能量单位为kJ•mol-1.(注:图中“吸”表示在催化剂表面的吸附)请回答下列问题:
2007年度诺贝尔化学奖获得者格哈德•埃特尔建立了合成氨反应机理,T=673K时,各步反应的能量变化如图所示,图中的能量单位为kJ•mol-1.(注:图中“吸”表示在催化剂表面的吸附)请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 24克金刚石中含有的碳碳键数目为4NA | |
| B. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| C. | 1L1mol•L-1饱和FeCl3溶液滴入沸水中完全水解生成Fe(OH)3胶体粒子数为NA | |
| D. | 120克熔融的NaHSO4中含有的离子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2溶于水:3NO2+H2O=H++NO3-+2NO | |
| B. | NaClO溶液中ClO-的水解:ClO-+H2O=HClO+OH- | |
| C. | 酸性条件下,用H2O2将I-转化为I2:H2O2+2I-+2H+=I2+2H2O | |
| D. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
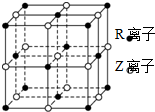 原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大.五种元素中,仅R为金属元素,其原子序数为27.X价电子排布式为nsnnpn,元素Z基态原子s电子总数与p电子总数相等,W与其它四种元素能层数不同,且未成对电子数目为1个.
原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大.五种元素中,仅R为金属元素,其原子序数为27.X价电子排布式为nsnnpn,元素Z基态原子s电子总数与p电子总数相等,W与其它四种元素能层数不同,且未成对电子数目为1个.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 50mL 0.55mol/L盐酸与50mL 0.50mol/LNaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
50mL 0.55mol/L盐酸与50mL 0.50mol/LNaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH3与CH4互为同系物 | |
| B. | 乙醇和乙酸都能与金属钠反应 | |
| C. | 正丁烷(CH3CH2CH2CH3)与异丁烷(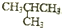 )互为同分异构体 )互为同分异构体 | |
| D. | 甲烷与苯在空气中燃烧的现象相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com