
下列溶液中各微粒浓度关系判定不正确的是
| A.10mL 0.2 mol·L-1的氨水与l0mL 0.1 mol·L-1的盐酸充分反应混合后的溶液中,存在c(NH4+)+c(NH3·H2O)=2c(Cl-)= 0.1 mol·L-1 |
| B.已知酸性HF > CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:c(Na+) - c(F-) >c(K+) - c(CH3COO-) |
| C.CH3COOK溶液中加入少量NaNO3固体后的碱性溶液一定有:c(K+)+c(H+)=c(CH3COO-)+c(OH-) |
| D.已知NaHS03溶液pH<7,该溶液中一定有:c(Na+)> c(HSO3-)> c(SO32-)>c(H2SO3) |
B
解析试题分析:A. n(Cl-)=c·V=0.1mol/L×0.01L=0.001mol.在反应的过程中没有消耗。反应后c(Cl-)="n/L" ="0.001mol" ÷0.02L="0.05mol/L." n(NH3)= c·V=0.1mol/L×0.02L=0.002mol.反应后 n(NH3) ="n/L=0.002mol" ÷0.02L=" 0.1" mol/L根据物料守恒可得c(NH3)= c(NH4+)+c(NH3·H2O)= 0.1mol/L="2" c(Cl-).正确。B. HF、CH3COOH都是弱酸,所以NaF与CH3COOK都是强碱弱酸盐。由于酸性HF > CH3COOH,所以根据盐的水解规律:有弱才水解,越弱越水解,谁强显谁性。水解程度CH3COO->F-。n(NaF)=n(CH3COOK).水解程度越大,剩余离子的浓度就越小。所以c(K+) —c(CH3COO-) >c(Na+) —c(F-)。错误。C. 在任何溶液中都存在着电荷守恒。即阳离子所带的正电荷总数与阴离子所带的负电荷总数相等。可得c(Na+)+c(K+)+c(H+)=c(CH3COO-)+c(OH-)+ c(NO3-)。由于NaNO3是强酸强碱盐,在溶液中不水解,所以c(Na+)=c(NO3-)。两式相减可得:c(K+)+c(H+)=c(CH3COO-)+c(OH-)。正确。D. NaHSO3是强碱弱酸的酸式盐。在溶液中存在电离平衡HSO3--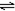 H++ SO32--,和水解平衡:HSO3+H2O--
H++ SO32--,和水解平衡:HSO3+H2O--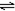 OH-+H2SO3。电离使溶液显酸性,水解使溶液显碱性。由于NaHSO3溶液pH<7,说明电离>水解。c(SO32-)>c(H2SO3).则根据物料守恒可得:c(Na+)= c(HSO3-) +c(SO32-)+ c(H2SO3)。由于c(HSO3-)的电离和水解消耗,所以c(Na+)> c(HSO3-)。因此在该溶液中一定有:c(Na+)> c(HSO3-)> c(SO32-) >c(H2SO3)。正确。
OH-+H2SO3。电离使溶液显酸性,水解使溶液显碱性。由于NaHSO3溶液pH<7,说明电离>水解。c(SO32-)>c(H2SO3).则根据物料守恒可得:c(Na+)= c(HSO3-) +c(SO32-)+ c(H2SO3)。由于c(HSO3-)的电离和水解消耗,所以c(Na+)> c(HSO3-)。因此在该溶液中一定有:c(Na+)> c(HSO3-)> c(SO32-) >c(H2SO3)。正确。
考点:考查溶液中各微粒浓度关系的知识。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
某温度下,pH相同的盐酸和氯化铵溶液分别稀释,pH随溶液体积变化的曲线如下图所示。据图判断下列叙述中,正确的是
| A.Ⅰ为氯化铵稀释时pH值变化曲线,Ⅱ为盐酸稀释时pH值变化曲线 |
| B.b点溶液中水的电离程度比d点溶液中水的电离程度大,但两点的KW相同 |
| C.a点时,等体积的两溶液分别与NaOH反应,消耗的NaOH量相同 |
| D.c点溶液的导电能力一定比b点溶液导电能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c (Na+) + c(H+)=c(OH-) + c(CH3COO-)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;
则有:Ka·Kh=Kw
⑤电解精炼铜时,电解质溶液中铜离子浓度不变 。
| A.①④ | B.①②④ | C.①②④⑤ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列事实可证明氨水中的(NH3?H2O)是弱碱的是
| A.氨水能被弱酸醋酸中和 | B.铵盐受热易分解 |
| C.氨水可以使酚酞试液变红 | D.常温下,0.1 mol/L氯化铵溶液的pH约为5 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将标准状况下1.12L氨气溶于500mL水中配制成溶液,从中取出5mL,有关这5mL溶液的叙 述正确的是
| A.溶液中c(NH4+)< c(OH—) | B.氨水的物质的量浓度为0.1 mol·L—1 |
| C.溶液的pH>13 | D.与5mL 0.1mol·L—1HCl溶液恰好完全中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述正确的是
| A.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:2c(Na+) + c(CH3COOH) = c(CH3COO-) +2c(OH-) |
| B.Ksp(AgCl)>Ksp(AgI)由此可以判断AgCl(S) + I- = AgI(S) + Cl-能够发生 |
| C.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| D.中和浓度与体积均相等的盐酸和醋酸溶液,消耗NaOH的物质的量不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是 ( )。
| A.在0.1 mol·L-1 Na2CO3溶液中:c(Na+)+c(H+)=c(CO32—)+c(HCO3—)+ c(OH-) |
| B.当溶液的pH为7时,溶液的总体积为20 mL |
| C.在B点所示的溶液中,浓度最大的阳离子是Na+ |
| D.在A点所示的溶液中:c(CO32—)=c(HCO3—)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25 ℃时,水的电离达到平衡:H2O H++OH-,下列叙述中正确的是( )
H++OH-,下列叙述中正确的是( )
| A.将纯水加热到95 ℃时,KW变大,pH不变,水仍呈中性 |
| B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,KW变小 |
| C.向纯水中加入少量固体碳酸钠,c(H+)减小,KW不变,影响水的电离平衡 |
| D.向纯水中加入醋酸钠或盐酸,均可抑制水的电离,KW不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com