
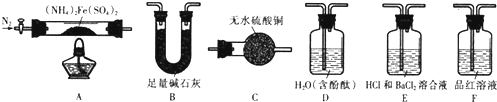
分析 实验I验证分解产物中含有氨气和水蒸气,选择装置A先通入氮气排净装置中的空气,加热分解硫酸亚铁铵,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等,通过装置C中无水硫酸铜检验生成的水,再通过装置B中的足量碱石灰除去水蒸气、硫的氧化物,通过装置D检验氨气的生成,通入后溶液变红色说明生成气体中含氨气;
验Ⅱ乙同学为探究分解产物中的硫氧化物,连接装置A-E-F-B进行实验,E中没有明显现象,F中溶液褪色,可说明生成硫氧化物为二氧化硫,没有生成三氧化硫,碱石灰用于吸收二氧化硫,防止污染空气,以此解答该题.
解答 解:(1)实验I验证分解产物中含有氨气和水蒸气,选择装置A先通入氮气排净装置中的空气,加热分解硫酸亚铁铵,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等,通过装置C中无水硫酸铜检验生成的水,再通过装置B中的足量碱石灰除去水蒸气、硫的氧化物,通过装置D检验氨气的生成,通入后溶液变红色说明生成气体中含氨气,所选用装置的正确连接顺序为ACBD,
故答案为:ACBD;
(2)利用无水硫酸铜遇到水变蓝色证明水蒸气生成,证明有水蒸气生成的实验现象为C中无水硫酸铜变蓝色,
故答案为:C中无水硫酸铜变蓝色;
(3)证明有氨气生成是利用氨气极易溶于水生成一水合氨,溶液显碱性使酚酞变红色,证明有氨气生成的实验现象为D中溶液变红色,
故答案为:D中溶液变红色;
(4)设计实验证明A中残留固体仅为Fe2O3,而不含FeO或Fe3O4,设计实验利用亚铁离子具有还原性可以使酸性高锰酸钾溶液褪色设计,取少量A中残留固体加入适量稀硫酸使其完全溶解,向溶液中滴加少量酸性高锰酸钾溶液,若高锰酸钾溶液不褪色,则残留固体是Fe2O3而不含FeO和Fe3O4,
故答案为:取少量A中残留固体加入适量稀硫酸使其完全溶解,向溶液中滴加少量酸性高锰酸钾溶液,若高锰酸钾溶液不褪色,则残留固体是Fe2O3而不含FeO和Fe3O4;
(5)E中含HCl的BaCl2溶液没有明显现象,说明无硫酸钡沉淀生成,证明分解产物中无三氧化硫生成,二氧化硫具有漂白性能使品红溶液褪色,F中溶液褪色说明有二氧化硫生成,
故答案为:分解产物中有SO2没有SO3;
(6)连接装置A-E-F-B进行实验,最后装置B是防止二氧化硫污染空气,
故答案为:吸收SO2防止污染空气;
(7)实验证明(NH4)2Fe(SO4)2受热分解生成氨气、二氧化硫、氧化铁、水,还有N2产生,结合原子守恒和电子守恒配平书写化学方程式为2(NH4)2Fe(SO4)2$\frac{\underline{\;500℃\;}}{\;}$Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O↑,
故答案为:2(NH4)2Fe(SO4)2$\frac{\underline{\;500℃\;}}{\;}$Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O↑.
点评 本题考查了物质组成的实验探究和实验设计,为高频考点,侧重于学生的分析能力、实验能力的考查,主要是实验基本操作、物质性质的理解应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
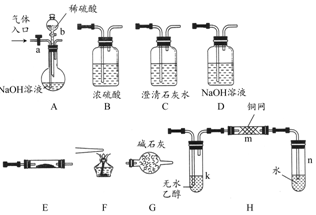 如图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择).
如图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有②④ | C. | 只有②③④ | D. | 只有①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
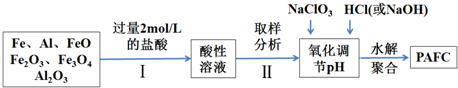
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
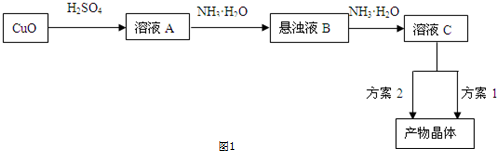

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
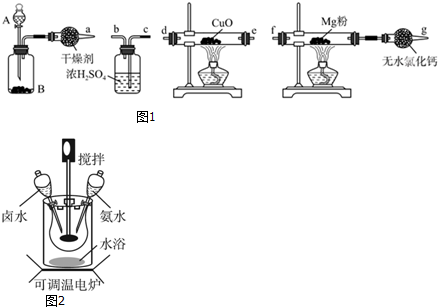
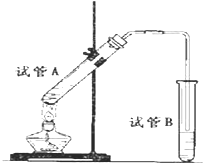 如图所示,中学化学实验室采用该装置用于制备乙酸乙酯.
如图所示,中学化学实验室采用该装置用于制备乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | NaF | CH3COONa | Na2S |
| pH | 7.5 | 9.5 | 11.8 |
| A. | 根据如,NaF的水解程度比CH3COONa的大 | |
| B. | 同体积、同pH的两种酸溶液消耗同浓度NaOH的体积:HF>CH3COOH | |
| C. | 向100mL 0.1 mol•L-1 CH3COONa溶液中通入224mL HF气体(标准状况):c(CH3COOH)+c(H+)═c(OH-)+c(F-) | |
| D. | 若将0.05 mol HC1缓慢地通入1 L 0.1 moL•L-Na2S溶液中,则溶液中离子浓度大小为:c(Cl-)>c(HS-)>c(OH-)c(S2-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com