
| 溶质 | NaF | CH3COONa | Na2S |
| pH | 7.5 | 9.5 | 11.8 |
| A. | 根据如,NaF的水解程度比CH3COONa的大 | |
| B. | 同体积、同pH的两种酸溶液消耗同浓度NaOH的体积:HF>CH3COOH | |
| C. | 向100mL 0.1 mol•L-1 CH3COONa溶液中通入224mL HF气体(标准状况):c(CH3COOH)+c(H+)═c(OH-)+c(F-) | |
| D. | 若将0.05 mol HC1缓慢地通入1 L 0.1 moL•L-Na2S溶液中,则溶液中离子浓度大小为:c(Cl-)>c(HS-)>c(OH-)c(S2-)>c(H+) |
分析 A、根据浓度为0.1moL•L-的溶液的pH可知,三种盐溶液的水解程度为:Na2S>CH3COONa>NaF;
B、根据“酸/碱越弱,则盐越水解”的规律可知,酸性:HS-<CH3COOH<HF,同体积、同pH的两种酸CH3COOH、HF溶液,醋酸的浓度更大;
C、向100mL 0.1 mol•L-1 CH3COONa溶液中通入224mL HF气体(标准状况),则两者能恰好完全反应生成等浓度的NaF和CH3COOH,溶液中存在电荷守恒和物料守恒,据此回答;
D、若将0.05 mol HC1缓慢地通入1 L 0.1 moL•L-Na2S溶液中,得到溶液的组成是0.05molNaCl,0.05molNa2S,0.05molNaHS,据离子的水解和电离原理来回答.
解答 解:A、浓度为0.1moL•L-的溶液的pH可知,三种盐溶液的水解程度为:CH3COONa>NaF,故A错误;
B、由于酸性HF>CH3COOH,故同体积、同pH的两种酸溶液中,故CH3COOH的物质的量多于HF,则消耗同浓度NaOH的体积:CH3COOH>HF,故B错误;
C、向100mL 0.1 mol•L-1 CH3COONa溶液中通入224mL HF气体(标准状况),则两者能恰好完全反应生成等浓度的NaF和CH3COOH,溶液中存在电荷守恒:c(CH3COO-)+c(H+)+c(Na+)═c(OH-)+c(F-),c(Na+)═c(CH3COO-)+c(CH3COOH),整理两式得到:c(CH3COOH)+c(H+)═c(OH-)+c(F-),故C正确;
D、若将0.05 mol HC1缓慢地通入1 L 0.1 moL•L-Na2S溶液中,得到溶液的组成是0.05molNaCl,0.05molNa2S,0.05molNaHS,溶液中离子浓度的大小为:c(HS-)>c(Cl-)>c(OH-)c(S2-)>c(H+),故D错误.
故选C.
点评 本题是一道关于盐的水解原理的应用知识的考查题,注意溶液三大守恒思想的灵活应用是关键,难度不大.


科目:高中化学 来源: 题型:解答题
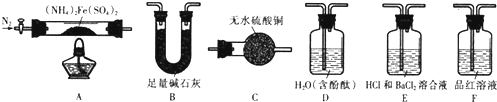
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
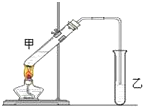 俗话说:“陈酒老醋特别香”,其原因是酒在存储过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示装置来模拟该过程,请回答下列问题:
俗话说:“陈酒老醋特别香”,其原因是酒在存储过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示装置来模拟该过程,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
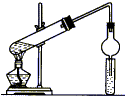 用如图所示装置制取乙酸乙酯,请回答以下问题.
用如图所示装置制取乙酸乙酯,请回答以下问题.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
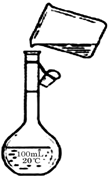 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量后转移固体时不小心把少量固体洒到烧杯外 | |
| B. | 加水定容时,加水过多,倒出后并恢复到刻度线水平 | |
| C. | 转移过程中不小心把几滴溶液滴在外面 | |
| D. | 干净的容量瓶又用蒸馏水洗涤了一遍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com