
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 用干燥洁净的玻璃棒蘸取待测溶液,滴在pH试纸上,再跟标准比色卡比较得到该溶液的pH值 |
分析 A.蒸发溶液应到大量固体析出时,靠余热蒸干;
B.温度计用于测量馏分温度,其水银球应该放在蒸馏烧瓶的支管口处;
C.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出;
D.用pH试纸测定溶液pH的方法为:用玻璃棒蘸取少许待测液滴在pH试纸上,然后把试纸显示的颜色与标准比色卡对照.
解答 解:A.蒸发操作时,蒸发皿中有量固体析出时停止加热,利用余热蒸干,不能蒸干,故A错误;
B.蒸馏的原理:通过控制沸点的不同来实现物质的分离,所以温度计水银球要靠近蒸馏烧瓶支管口,故B正确;
C.为防止液体污染,分液时分液漏斗中下层液体从下口放出,上层液体从上口倒出,故C正确;
D.用广泛pH试纸测定溶液pH时,试纸不能湿润,否则可能影响测定结果,题中操作方法合理,故D正确;
故选A.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及蒸发、蒸馏、分液、pH试纸的使用方法等知识,明确常见化学实验基本操作方法为解答关键,试题培养了学生的分析能力及化学实验能力.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | NaOH、Al--电解质 | B. | C2H4、O2--易燃气体 | ||
| C. | CaC2、K--遇湿易燃物品 | D. | KMnO4、KClO3--还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
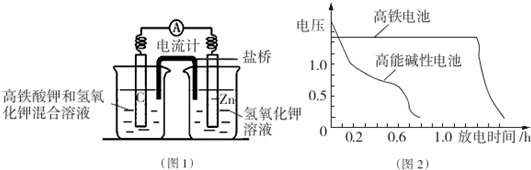
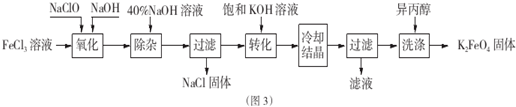
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇的分子式:CH3CH2OH | B. | 次氯酸的电子式: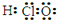 | ||
| C. | NH4Cl的电子式: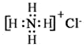 | D. | 乙醛结构简式:CH3CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 578 | 1817 | 2745 | 11575 | 14830 | 18376 | 23293 |
| A. | ⅠA | B. | ⅡA | C. | ⅢA | D. | ⅣA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4C1溶液因水解而显酸性,故NH4C1是弱电解质 | |
| B. | 纯碱溶液因水解而显碱性,水解的离子方程式为:CO32-+H2O?H2CO3+2OH- | |
| C. | 可乐因含碳酸而显酸性,电离方程式为:H2CO3?CO32-+2H+ | |
| D. | 配制FeC13 溶液时,先将FeC13 溶于较浓的盐酸中,然后再加水稀释到所需浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com