

| A.NaOH溶液与三种酸的反应均是吸热反应 |
| B.滴定酸HY可用酚酞作指示剂 |
| C.酸性强弱:HX>HY>HZ |
| D.滴定三种酸都可用甲基橙作指示剂 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.水的离子积通常用KW来表示,随温度变化而变化,只适用于纯水,在稀盐酸中数值会变大 |
| B.在纯水中加入硫酸会抑制水的电离,加醋酸会促进水的电离 |
| C.盐溶于水对水的电离平衡均没有影响 |
| D.在纯水中加入氢氧化铁固体对水的电离平衡会有微弱的影响 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
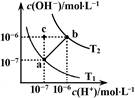
| A.ab线上任意点溶液均显中性 |
| B.b点时,溶液的pH=6,显酸性 |
| C.图中温度T1>T2 |
| D.在水中通入适量HCl气体可从a点变到c点 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
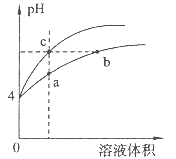
| A.a、c两点溶液的导电能力相同 |
| B.b点溶液中c(H+)+c(NH3·H2O)=c(OH-) |
| C.a、b、c三点溶液中水的电离程度a>b>c |
| D.用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb=Vc |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.HA的浓度为l×10-4mol·L-1 |
| B.实验时可选甲基橙作指示剂 |
| C.V=10mL,酸碱恰好中和 |
| D.pH=7时,溶液中c(Na+)>c(A-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:60 | B.3:1 | C.100:l | D.1:100 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
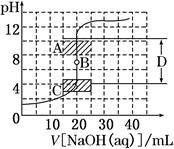
| 实验序号 | 消耗0.1 032 mol·L-1的盐酸溶液的体积/mL | 待测氢氧化钠溶液的体积/mL |
| 1 | 28.84 | 25.00 |
| 2 | 27.83 | 25.00 |
| 3 | 27.85 | 25.00 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.取20.00mL待测硫酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞试液 |
| B.用标准氢氧化钠溶液润洗滴定管2~3次 |
| C.把盛有标准氢氧化钠溶液碱式滴定管固定好,调节滴定管尖嘴使之充满溶液 |
| D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2~3mL |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com