
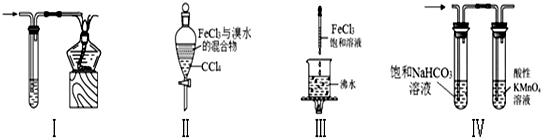
| A. | 装置Ⅰ:可用于处理CO尾气 | |
| B. | 装置Ⅱ:充分振荡后静置,下层溶液为红棕色,上层无色 | |
| C. | 装置Ⅲ:当液体呈红褐色,停止加热,让光束通过体系可产生丁达尔效应 | |
| D. | 装置Ⅳ:可用于除去CO2气体中的HCl和SO2气体 |
分析 A.CO有毒,燃烧可生成无毒的二氧化碳;
B.上层为氯化铁溶液,为黄色;
C.饱和氯化铁溶液在沸水中水解生成氢氧化铁胶体;
D.HCl极易溶于水,二氧化硫易被高锰酸钾氧化.
解答 解:A.CO有毒,燃烧可生成无毒的二氧化碳,图中装置合理,故A正确;
B.四氯化碳的密度比水的大,充分振荡后静置,下层溶液为橙红色,上层为氯化铁溶液,为黄色,故B错误;
C.饱和氯化铁溶液在沸水中水解生成氢氧化铁胶体,胶体有丁达尔效应,故C正确;
D.HCl极易溶于水,二氧化硫易被高锰酸钾氧化,且不会引入新杂质,则装置④的实验可除去CO2中的HCl和SO2气体,故D正确.
故选B.
点评 本题考查化学实验方案的评价,考查较为综合,涉及除杂、分液、胶体的制备等,侧重于学生的实验能力和评价能力的考查,为高考常见题型,注意把握相关物质的性质以及实验方法,难度中等.


科目:高中化学 来源: 题型:选择题

| A. | b端是直流电源的负极 | |
| B. | 实验过程中溶液的导电能力没有明显变化 | |
| C. | 通电一段时间后,在阴极附近观察到黄绿色气体 | |
| D. | 若将甲电极换成铁棒,乙电极换成铜棒,则可实现在铁棒上镀铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
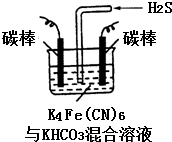 铁及其化合物在日常生活中应用广泛.
铁及其化合物在日常生活中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3和NaHCO3的固体混合物,加热时有气体产生,加水溶解时有沉淀生成. | |
| B. | 25℃与60℃时,水的pH相等 | |
| C. | 中和等体积、等物质的量的浓度的盐酸和醋酸所消耗的n(NaOH)不相等 | |
| D. | 2SO2(g)+O2(g)═2SO3(g)和 4SO2(g)+2O2(g)=4SO3(g)的△H相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液与足量氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 用醋酸除水垢:2CH3COOH+CaCO3═2CH3COO-+Ca2++H2O+CO2↑ | |
| C. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| D. | 用K37ClO3与浓盐酸制氯气:37ClO3-+6H++6Cl-═37Cl-+3Cl2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
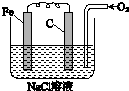 金属腐蚀的电化学原理可用如图模拟.
金属腐蚀的电化学原理可用如图模拟.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态HCl、固态NaCl均不导电,所以HCl、NaCl是非电解质 | |
| B. | NH3、CO2、Cl2的水溶液均能导电,所以NH3、CO2、Cl2均是电解质 | |
| C. | 强电解质在固态或液态时,可能不导电 | |
| D. | 铜、石墨均导电,所以它们是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2FeCl3+S2-═2FeCl2+S↓ | B. | 2FeCl3+H2S═2FeCl2+S↓+2H++2Cl- | ||
| C. | 2Fe3++S2-═2Fe2++S↓ | D. | 2Fe3++H2S═2Fe2++S↓+2H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com