
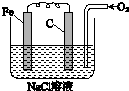
 金属腐蚀的电化学原理可用如图模拟.
金属腐蚀的电化学原理可用如图模拟.分析 (1)图示为Fe的吸氧腐蚀,负极上Fe失电子生成亚铁离子,正极上氧气得电子生成氢氧根离子;在NaCl溶液中发生吸氧腐蚀;
(2)将NaCl溶液改为稀H2SO4溶液,变成析氢腐蚀;保护铁棒时,负极应为比铁活泼的金属.
解答 解:(1)图示为Fe的吸氧腐蚀,负极上Fe失电子生成亚铁离子,正极上氧气得电子生成氢氧根离子,铁棒上的电极反应式为:2Fe-4e-═2Fe2+,碳棒上的电极反应式为:O2+2H2O+4e-═4OH-;在NaCl溶液中发生吸氧腐蚀,故答案为:Fe-2e-═Fe2+;O2+2H2O+4e-═4OH-;吸氧;
(2)将NaCl溶液改为稀H2SO4溶液,变成析氢腐蚀;保护铁棒时,负极应为比铁活泼的金属,故答案为:析氢;锌(或其他比铁活泼的金属).
点评 本题考查了金属的腐蚀和防护,注意吸氧腐蚀和析氢腐蚀的区别,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 整个过程中,H20的电离度逐渐增大 | B. | c(Na+)>c(HS-)>c(H+)>c(S2-)>c(0H-) | ||
| C. | c(Na+)+c(H+)═c(0H-)+c(HS-)+2c(S2-) | D. | c(Na+)═c(HS-)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
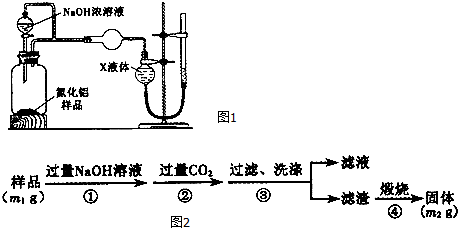
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
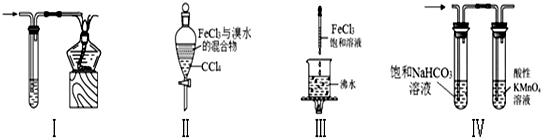
| A. | 装置Ⅰ:可用于处理CO尾气 | |
| B. | 装置Ⅱ:充分振荡后静置,下层溶液为红棕色,上层无色 | |
| C. | 装置Ⅲ:当液体呈红褐色,停止加热,让光束通过体系可产生丁达尔效应 | |
| D. | 装置Ⅳ:可用于除去CO2气体中的HCl和SO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
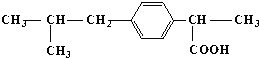
| A. | ③⑤ | B. | ②③ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
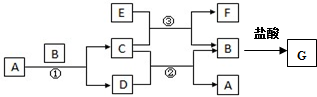
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
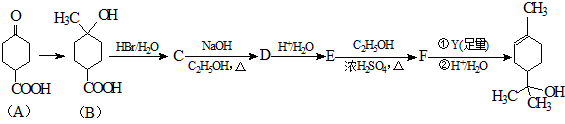
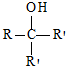
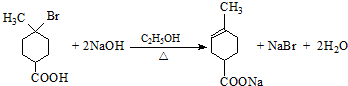 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com