
| A. | ①②④ | B. | ②③⑤ | C. | ②③⑤⑥ | D. | ①②③⑤ |
分析 金属的冶炼一般有电解法、热还原法、热分解法、物理分离法,金属活动顺序表中的金属冶炼:活泼金属K、Ca、Na、Mg、Al一般用电解熔融的氯化物(AI是电解熔融的三氧化二铝)制得;较不活泼的金属Zn、Fe、Sn、Pb、Cu等用热还原法制得,常用还原剂有(C、CO、H2等);Hg、Ag用加热分解氧化物的方法制得,Pt、Au用物理分离的方法制得,以此来解答.
解答 解:①MgCl2→Mg、⑥KCl→K利用电解法冶炼;
②MnO2→Mn、③ZnO→Zn、⑤磁铁矿→Fe均可利用热还原法冶炼;
④HgO→Hg利用加热分解法,
故选B.
点评 本题考查金属的冶炼,为高频考点,把握金属活泼性及金属冶炼原理为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
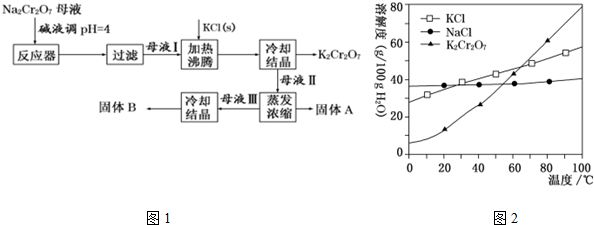
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

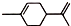 ),则A的系统命名是2-甲基-1,3-丁二烯.在合成M的过程中还可以生成M的一种同分异构体,其结构简式为
),则A的系统命名是2-甲基-1,3-丁二烯.在合成M的过程中还可以生成M的一种同分异构体,其结构简式为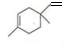 .
.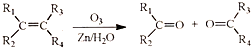 (R1、R2、R3、R4为烃基或氢原子)
(R1、R2、R3、R4为烃基或氢原子)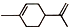 )发生上述反应的产物中分子量较大的结构简式
)发生上述反应的产物中分子量较大的结构简式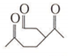 .
.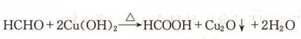 .
.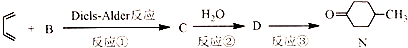
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是酚酞变红色的溶液:K+、Fe3+、SO42-、Cl- | |
| B. | 水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、AlO2-、CO32- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、Na+、NO3-、SO42- | |
| D. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-13mol/L的溶液中:NH4+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
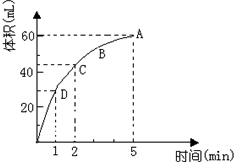 加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示(假设溶液体积不变),回答下列问题:
加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示(假设溶液体积不变),回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
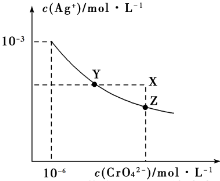
| A. | 在 t℃时,AgCl 的溶解度大于 Ag2CrO4 | |
| B. | 在 t℃时,Ag2CrO4的 Ksp=1×10-1210-3 | |
| C. | 在饱和 Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点到X 点 | |
| D. | 在 t℃时,用 AgNO3 标准溶液滴定 20mL 未知浓度的 KCl 溶液,不能采用K2CrO4溶液为指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4原子半径最大的是① | |
| B. | 具有下列最外层电子排布式的原子中,①3s23p1②3s23p2 ③3s23p3 ④3s23p4第一电离能最大的是③ | |
| C. | ①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ | |
| D. | 某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com