
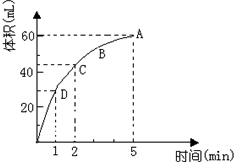
 加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示(假设溶液体积不变),回答下列问题:
加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示(假设溶液体积不变),回答下列问题:分析 (1)反应方程式为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,根据图象可知生成的氧气的体积;
(2)反应放出气体体积为气体总体积一半为30mL,根据图象判断需要的时间;
(3)反应放出气体体积为气体总体积的$\frac{3}{4}$时,生成的气体体积为45mL,根据图象判断反应时间;
(4)根据浓度对反应速率的影响判断A、B、C、D各点反应速率大小;
(5)随着反应的进行,溶液的浓度逐渐降低,反应速率逐渐减小;
(6)在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,根据图象可知生成的氧气的体积,根据方程式计算过氧化氢浓度;根据m=ρV计算原溶液质量,根据方程式计算分解的过氧化氢,此时溶液质量=原溶液质量-氧气质量,进而计算此时过氧化氢的质量分数.
解答 解:(1)由反应方程式为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可知,生成氧气的体积为60mL,
故答案为:60mL;
(2)由图象可知,当时间进行到1min时,生成氧气的体积为30mL,此时生成的氧气为总体积的一半,需要的时间为1min,
故答案为:1min;
(3)生成的总体积为60mL,反应放出气体体积为气体总体积的$\frac{3}{4}$时,生成的氧气体积为45mL,需要的时间为2min,
故答案为:2min;
(4)反应物浓度大小决定反应速率大小,随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小,
故答案为:D>C>B>A;
(5)浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小,
故答案为:随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小;
(6)由反应方程式为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,
由图象可知,生成氧气的体积为60mL,
2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,
2mol 22.4L
n(H2O2) 0.06L
n(H2O2)=$\frac{2mol×0.06L}{22.4L}$=0.00536mol,所以c(H2O2)=$\frac{0.00536mol}{0.05L}$=0.11 mol•L-1,
原溶液质量为50mL×1.1g•mL-1=55g,2min时生成氧气物质的量为$\frac{0.045L}{22.4L/mol}$=0.002,由2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,可知分解的H2O2的物质的量为0.002mol×2=0.004mol,剩余的过氧化氢为(0.0054mol-0.004mol)×34g/mol=0.0476g,此时溶液质量=55g-0.002mol×32g/mol=54.936g,故此时过氧化氢的质量分数=$\frac{0.0476g}{54.936g}$×100%=0.087%,
故答案为:0.11 mol•L-1;0.087%.
点评 本题考查过氧化氢分解的速率曲线,题目难度中等,主要考查浓度对反应速率的影响,正确分析图象的曲线变化是解答本题的关键.


科目:高中化学 来源: 题型:选择题

| A. | 不能用FeCl3 溶液鉴别水杨酸和阿司匹林 | |
| B. | 服用阿司匹林出现水杨酸反应时,可静脉注射NaHCO3溶液 | |
| C. | 1 mol阿司匹林最多可消耗2 mol NaOH | |
| D. | 该反应不属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,33.6LHF中含有氟原子的数目为1.5NA | |
| B. | 12g石墨和C60的混合物中质子总数为6NA | |
| C. | 在0.1mol•L-1的碳酸钠溶液中,阴离子总数一定大于0.lNA | |
| D. | 标准状况下,0.1mol己烷中共价键数目为19NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 点①所示溶液中:2c(CH3COO-)-2c(CH3COOH)=c(H+)-c(OH-) | |
| B. | 点②所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 点③所示溶液中:c(CH3COO-)-c(CH3COOH)=c(Na+)+2c(H+)-2c(OH-) | |
| D. | pH=12的溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)>c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③⑤ | C. | ②③⑤⑥ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管在装酸液前用标准盐酸溶液润洗2~3次 | |
| B. | 开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 | |
| C. | 锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 | |
| D. | 盛NaOH溶液的锥形瓶滴定前未用NaOH溶液润洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者相等 | B. | 前者比后者大11倍 | ||
| C. | 后者是前者的108倍 | D. | 后者是前者的1011倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl、HCl、H2O、H2 | B. | Cl2、Na2S、HCl、SO2 | ||
| C. | HBr、CO2、NH3、CS2 | D. | Na2O2、H2O2、H2O、O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com