
| A. | 标准状况下,33.6LHF中含有氟原子的数目为1.5NA | |
| B. | 12g石墨和C60的混合物中质子总数为6NA | |
| C. | 在0.1mol•L-1的碳酸钠溶液中,阴离子总数一定大于0.lNA | |
| D. | 标准状况下,0.1mol己烷中共价键数目为19NA |
分析 A.气体摩尔体积使用对象为气体;
B.石墨和C60中都是有C原子组成,12g混合物中含有12gC,含有1mol碳原子,含有6mol质子;
C.溶液体积未知;
D.1个己烷分子中含有5个C-C键,含有14个C-H键.
解答 解:A.标况下HF不是气体,不能使用气体摩尔体积,故A错误;
B.12g石墨和C60的混合物中含有12gC,含有1mol碳原子,1molC中含有6mol质子,含有的质子总数为6NA,故B正确;
C.溶液体积未知,无法计算阴离子个数,故C错误;
D.1个己烷分子中含有5个C-C键,含有14个C-H键,所以0.1mol己烷中共价键数目为1.9NA,故D错误
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下己烷、氢氟酸标况下不是气体,熟练掌握公式的使用和物质的结构是解题关键.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1mol/LCH3COOH溶液中所含分子总数 | |
| B. | 1molCl2参加化学反应获得的电子数 | |
| C. | 常温常压下,11.2LN2和NO的混合气体所含的原子数 | |
| D. | 28g铁在反应中作还原剂时,失去电子的数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成气体体积为560mL | B. | 反应中电子转移数目为0.1NA | ||
| C. | Na2O2粉末中含离子数目为0.15NA | D. | 所得溶液pH为13 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

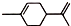 ),则A的系统命名是2-甲基-1,3-丁二烯.在合成M的过程中还可以生成M的一种同分异构体,其结构简式为
),则A的系统命名是2-甲基-1,3-丁二烯.在合成M的过程中还可以生成M的一种同分异构体,其结构简式为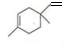 .
.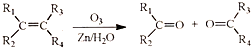 (R1、R2、R3、R4为烃基或氢原子)
(R1、R2、R3、R4为烃基或氢原子)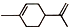 )发生上述反应的产物中分子量较大的结构简式
)发生上述反应的产物中分子量较大的结构简式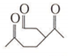 .
.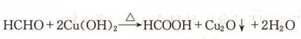 .
.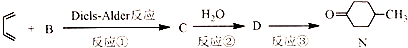
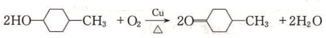 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
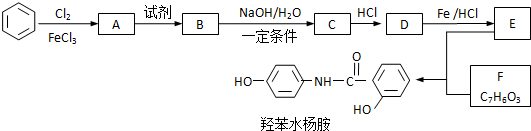
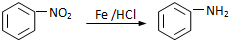
 .
.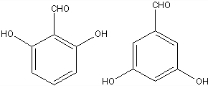 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是酚酞变红色的溶液:K+、Fe3+、SO42-、Cl- | |
| B. | 水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、AlO2-、CO32- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、Na+、NO3-、SO42- | |
| D. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-13mol/L的溶液中:NH4+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
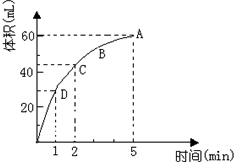 加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示(假设溶液体积不变),回答下列问题:
加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示(假设溶液体积不变),回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 陈述I | 陈述II |
| A | 酸性:HCl>H2CO3 | 非金属性:Cl>C |
| B | K+、Ca2+、Mg2+ 的离子半径依次减小 | K+、Ca2+、Mg2+氧化性性依次增强 |
| C | 硬铝是合金 | 其熔点比金属铝的熔点低 |
| D | 电镀时阳极上发生还原反应 | 可在铁的镀件上镀铜 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com