
���� ��1�����ݷ�Ӧ����ʽ����ѧƽ�������ʽ�����㣻
��2������v=$\frac{��c}{��t}$��Ϸ�Ӧ����֮�ȵ��ڻ�ѧ������֮�ȼ��㣮
��� �⣺��1����SO2����ʼ���ʵ���Ϊn��
2SO2 +O2?2SO3
��ʼ��n 14mol 0
ת����4mol 2mol 4mol
2min��2mol 12mol 4mol
��n-4mol=2mol��n=6mol��
2min��������4molSO3��SO2����ʼ���ʵ���Ũ���ǣ�$\frac{6mol}{10L}$=0.6mol/L��
�ʴ�Ϊ��4��0.6mol/L��
��2��2min��ƽ����Ӧ���ʣ�v��SO2��=$\frac{\frac{4mol}{10L}}{2min}$=0.2mol/��L•min����v��SO3��=v��SO2��=0.2mol/��L•min����v��O2��=$\frac{1}{2}$v��SO2��=0.1mol/��L•min����
�ʴ�Ϊ��0.2��0.1��0.2��
���� ���⿼�黯ѧƽ��ļ��㣬��Ŀ�ѶȲ���ע�⻯ѧƽ�����������ʽ�������ã�ע�����ջ�ѧ��Ӧ���ʵĸ������ʽ��������ؿ���ѧ���ķ�����������������ѧ����������


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 mol������1 mol Ba��OH��2��ȫ�к����ų�������Ϊ�к��� | |
| B�� | 101 kPaʱ��1 mol̼ȼ�����ų�������Ϊ̼��ȼ���� | |
| C�� | CO�Dz��ȶ�����������ܼ�����������Ӧ�����ȶ���CO2������CO��ȼ�շ�Ӧһ�������ȷ�Ӧ | |
| D�� | 25�桢101 kPaʱ��1 mol S��2 mol S��ȼ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | n=2 | |
| B�� | ��һ�δ�ƽ��ʱ����Ӧ���ĵ�AΪ0.7 mol | |
| C�� | ���뵪����Ӧ���ʼӿ죬ƽ�������ƶ� | |
| D�� | ����Ӧ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 16.7% | B�� | 50% | C�� | 66.7% | D�� | 83% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
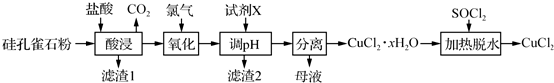
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
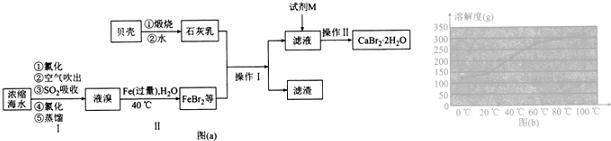
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 60% | B�� | 40% | C�� | 24% | D�� | 4% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com