
| A. | 1 mol硫酸与1 mol Ba(OH)2完全中和所放出的热量为中和热 | |
| B. | 101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 | |
| C. | CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应 | |
| D. | 25℃、101 kPa时,1 mol S和2 mol S的燃烧热相等 |
分析 A.根据中和热的概念分析,中和热是指强酸、强碱生成1mol水放出的热量,SO42-和Ba2+反应生成BaSO4,需要放出热量;
B.根据燃烧热指1mol可燃物完全燃烧生成稳定的化合物时所放出的热量;
C.根据物质的能量越低越稳定;
D.根据燃烧热指1mol可燃物完全燃烧生成稳定的化合物时所放出的热量,燃烧热与物质的物质的量的多少无关.
解答 解:A.1 mol 硫酸与1mol Ba(OH)2 完全中和生成硫酸钡沉淀和2molH2O,同时SO42-和Ba2+反应生成BaSO4,需要放出热量,所以放出的热量不是中和热,故A错误;
B.101kPa时,1mol碳燃烧若没有生成稳定的氧化物所放出的热量就不是碳的燃烧热,故B错误;
C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,能量越低越稳定,所以CO的燃烧反应一定是放热反应,故C错误;
D.燃烧热与物质的物质的量的多少无关,所以在25℃.101kPa下,1 mol 硫和2 mol硫燃烧热相等,故D正确;
故选D.
点评 本题考查中和热和燃烧热的概念,注意对概念的理解是解题的关键


科目:高中化学 来源: 题型:选择题
| A. | c1:c2=1:3 | |
| B. | 当4v(X)正=v(Y)逆时,该反应还在向逆反应方向建立平衡 | |
| C. | X、Y的转化率不相等 | |
| D. | Y起始浓度c2可能为0.36mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH的燃烧热为192.9kJ/mol | |
| B. | 反应①要吸收热量,故反应②更实用些 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H>-192.9kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
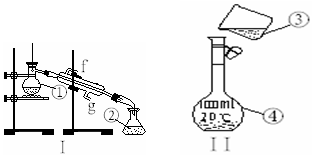 掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
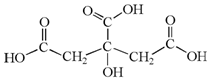 柠檬中含有的柠檬酸(其结构简式如下)对鲜切苹果具有较好的保鲜效果,可以在一段时间内防止鲜切苹果表面变色.下列说法不正确的是( )
柠檬中含有的柠檬酸(其结构简式如下)对鲜切苹果具有较好的保鲜效果,可以在一段时间内防止鲜切苹果表面变色.下列说法不正确的是( )| A. | 柠檬酸的分子式是C6H8O7 | B. | 柠檬酸是易溶于水的有机物 | ||
| C. | 柠檬酸分子中含有羧基和羟基 | D. | 柠檬酸只能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其他条件不变,增大该体系的压强,平衡正向移动,则C为气体 | |
| B. | 其他条件不变.若升高温度.B的平衡转化率增大.则该反应是放热反应 | |
| C. | 该反应的化学平衡常数表达式为K=$\frac{{c}^{4}(C)•{c}^{2}(D)}{{c}^{3}(A)•{c}^{2}(B)}$ | |
| D. | 此时.B的平衡转化率是40% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原溶液中c(Fe3+)=0.2mol•L-1 | |
| B. | SO42-、NH4+、Na+一定存在,CO32-一定不存在 | |
| C. | 要确定原溶液中是否含有Fe2+,其操作为取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有Fe2+ | |
| D. | 溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
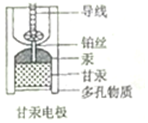 饱和甘汞电极(Hg-Hg2Cl2)因其电动势稳定,常被用作参比电极,其内部构造如图所示,当甘汞电极与锌共同插入ZnCl2溶液中构成原电池时,下列说法正确的是( )
饱和甘汞电极(Hg-Hg2Cl2)因其电动势稳定,常被用作参比电极,其内部构造如图所示,当甘汞电极与锌共同插入ZnCl2溶液中构成原电池时,下列说法正确的是( )| A. | 负极的电极反应式为Zn-2e-═Zn2+ | |
| B. | 正极的电极反应式为Hg2Cl2+2e-═2Hg+2Cl- | |
| C. | 多孔物质相当于盐桥 | |
| D. | 甘汞电极中,Cl-既不是反应物,也不是产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com