
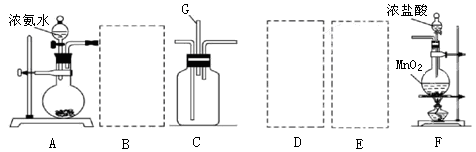

 Mn2++Cl2↑+2H2O (2分)(2)ABE (3分)
Mn2++Cl2↑+2H2O (2分)(2)ABE (3分)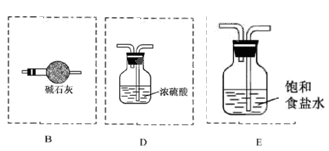 (3分)
(3分) Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。 NH4++OH-,碱石灰、生石灰和烧碱溶于水放出热量,且增大溶液中OH-的浓度,促使平衡向逆反应方向移动 进而放出氨气。二氧化硅不溶于水,五氧化二磷虽然溶于水时放热,但溶液显酸性,得不到氨气。因此正确的答案选A、B、E。
NH4++OH-,碱石灰、生石灰和烧碱溶于水放出热量,且增大溶液中OH-的浓度,促使平衡向逆反应方向移动 进而放出氨气。二氧化硅不溶于水,五氧化二磷虽然溶于水时放热,但溶液显酸性,得不到氨气。因此正确的答案选A、B、E。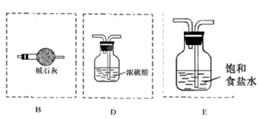 。
。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:实验题
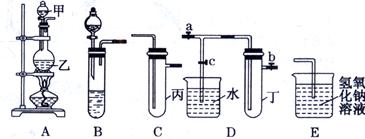
| 实验 序号 | 实验操作 | 现象 |
| Ⅰ | 将氯水滴入品红溶液 | ① |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 化学式 | 熔点(单位:℃) | 沸点(单位:℃) |
| N2 | -209.86 | -195.8 |
| O2 | -218.4 | -183 |
| CO2 | -57 | / |
| NH3 | -77.3 | -33.35 |
| Cl2 | -101 | -34.6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
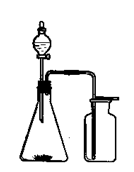
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
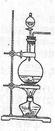

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
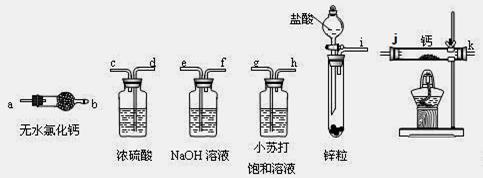
| A.加热反应一段时间 | B.收集气体并检验其纯度 |
| C.关闭分液漏斗活塞 | D.停止加热,充分冷却 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
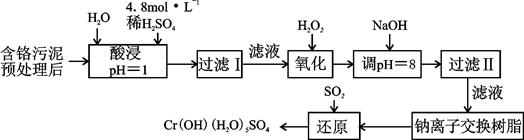
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | —— | —— | 4.7 | —— |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
 Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)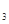 的溶度积Ksp= c(Cr3+)? c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
的溶度积Ksp= c(Cr3+)? c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
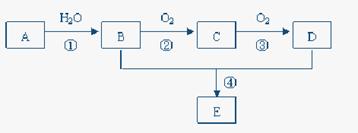
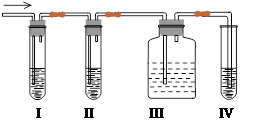
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com