

| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:阅读理解
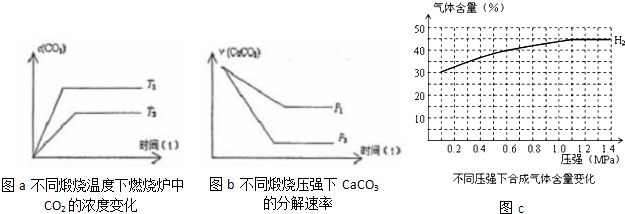
| 流程1:气化炉中产生H2 | 流程2:燃烧炉中CaO再生 |
| 通入水蒸气,主要化学反应: ①C(s)+H2O(g)=CO(g)+H2(g) △H=+131.6kJ?mol-1 ②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJ?mol-1 ③CaO(s)+CO2(g)=CaCO3(s) △H=-178.3kJ?mol-1 |
通入纯氧,主要化学反应: ④C(s)+O2(g)=CO2(g) △H=-393.8kJ?mol-1 ⑤CaCO3(s)=CaO(s)+CO2(g) K |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com