
| 流程1:气化炉中产生H2 | 流程2:燃烧炉中CaO再生 |
| 通入水蒸气,主要化学反应: ①C(s)+H2O(g)=CO(g)+H2(g) △H=+131.6kJ?mol-1 ②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJ?mol-1 ③CaO(s)+CO2(g)=CaCO3(s) △H=-178.3kJ?mol-1 |
通入纯氧,主要化学反应: ④C(s)+O2(g)=CO2(g) △H=-393.8kJ?mol-1 ⑤CaCO3(s)=CaO(s)+CO2(g) K |
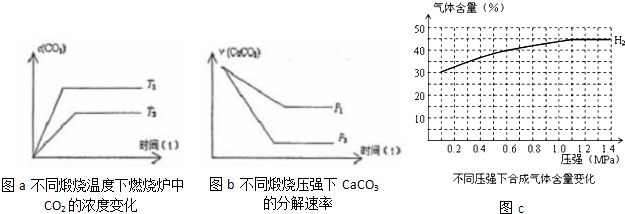
| 178.3kJ |
| 393.8kJ/mol |
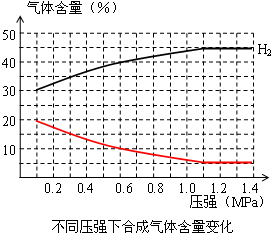 ,故答案为:
,故答案为: ;
;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| e |
| 2 |
| 1 |
| 2 |
| b-a |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
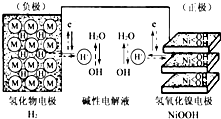 (2013?绍兴一模)航天器中常使用可充电电池,构造示意图如图(氢化物电极为储氢金属,可看做H2直接参加反应).白天太阳能帆板发电,将一部分电量储存在镍氢电池里,夜晚镍氢电池供电.下列说法正确的是( )
(2013?绍兴一模)航天器中常使用可充电电池,构造示意图如图(氢化物电极为储氢金属,可看做H2直接参加反应).白天太阳能帆板发电,将一部分电量储存在镍氢电池里,夜晚镍氢电池供电.下列说法正确的是( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com