
【题目】下列装置中能形成原电池的是( )

A. ①③⑤B. ②④⑥C. ①⑤⑥D. ②③④
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 100 mL 1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是( )
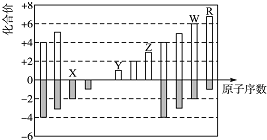
A. 原子半径:X<Y<Z
B. 气态氢化物的稳定性及其水溶液的酸性:R>W
C. W、X形成的化合物以及它们与水反应生成物都是共价化合物
D. Y、Z、W的最高价氧化物对应的水化物两两之间都能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃A分子式为C8H10,它的主要用途是在石油化学工业作为生产苯乙烯的中间体,所制成的苯乙烯一般被用来制备常用的塑料制品——聚苯乙烯。某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色。J分子内有两个互为对位的取代基。在一定条件下各物质间有如下的转化关系:(无机物略去)

(1)A物质的名称为__________。写出核磁共振氢谱中只有2个特征峰的A的同分异构体的结构简式__________________。
(2)写出X的结构简式______________;J中所含的含氧官能团的名称为_________。
(3)E与H反应的化学方程式是_______________;反应类型是______________。
(4)B、C的混合物在NaOH 乙醇溶液中加热可以生成同一种有机物I,以I为单体合成的高分子化合物的结构简式是_________________。
(5)已知J有多种同分异构体,写出一种符合下列性质的J的同分异构体的结构简式________。
①与FeCl3溶液作用显紫色;②与新制Cu(OH)2悬浊液作用产生红色沉淀;
③苯环上的一卤代物有2种;④能发生水解反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列叙述错误的是
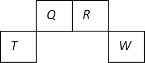
A. T的氧化物能与碱反应
B. 元素的非金属性:Q强于W
C. W的单质共热时,能与其最高价氧化物的水化物浓溶液反应
D. 原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Science杂志在2017 年报道了世界上首个成功合成的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(白色固体),这是全氮含能材料里程碑式的突破。该盐结构如图,下列分析不合理的是
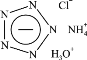
A. 五氮阴离子的化学式为N5—
B. 该盐中阴阳离子数目之比为 ![]()
C. 该盐在碱中比在酸中稳定
D. 该盐存在离子键和共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①Na2S、②金刚石、③NH4Cl、④Na2SO4、⑤干冰、⑥碘片六种物质,按下列要求回答:
(1)熔化时不需要破坏化学键的是____________,熔化时需要破坏共价键的是____________,熔点最高的是____________,熔点最低的是_____________(填序号)。
(2)属于离子化合物的是_______________________,只有离子键的物质是____________,以分子间作用力结合的物质是____________________(均填序号),③的电子式____________________。
(3)用电子式表示①的形成过程是______________________,用电子式表示⑥的形成过程是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。下图是元素周期表的一部分,回答下列问题:

(1)元素Ga在元素周期表中的位置为:______________。
(2)Sn的最高正价为________,Cl的最高价氧化物对应水化物的化学式为________,Bi的最高价氧化物的化学式为________。
(3)根据元素周期律,推断:
①阴影部分元素形成的氢化物中沸点最高的是________。
②H3AsO4、H2SeO4的酸性强弱为:H3AsO4________H2SeO4(填“>”、“<”、“=”或“无法比较”)。
③氢化物的还原性:H2O________H2S(填“>”、“<”、“=”或“无法比较”)。
④原子半径比较:N________Si(填“>”、“<”、“=”或“无法比较”)。
(4)可在图中分界线(虚线部分)附近寻找________(填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料 D.农药
(5)若比较C、Si的非金属性强弱,请从下列试剂中选择最佳试剂组合进行实验, 请写出实验过程:(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液) _______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com