
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。下图是元素周期表的一部分,回答下列问题:

(1)元素Ga在元素周期表中的位置为:______________。
(2)Sn的最高正价为________,Cl的最高价氧化物对应水化物的化学式为________,Bi的最高价氧化物的化学式为________。
(3)根据元素周期律,推断:
①阴影部分元素形成的氢化物中沸点最高的是________。
②H3AsO4、H2SeO4的酸性强弱为:H3AsO4________H2SeO4(填“>”、“<”、“=”或“无法比较”)。
③氢化物的还原性:H2O________H2S(填“>”、“<”、“=”或“无法比较”)。
④原子半径比较:N________Si(填“>”、“<”、“=”或“无法比较”)。
(4)可在图中分界线(虚线部分)附近寻找________(填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料 D.农药
(5)若比较C、Si的非金属性强弱,请从下列试剂中选择最佳试剂组合进行实验, 请写出实验过程:(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液) _______________。
【答案】第四周期 ⅢA族 +4 HClO4 Bi2O5 HF < < < B 在试管中加入CaCO3固体,再加入盐酸,将生成气体通过饱和NaHCO3溶液洗气后,通入Na2SiO3溶液;生成白色胶状沉淀,则碳酸酸性强于硅酸,即C的非金属性强于Si
【解析】
(1)元素Ga和B、Al在同一主族,并且在Al元素的下一个周期,所以Ga在周期表中的位置为:第四周期 ⅢA族。答案:第四周期 ⅢA族。
(2)由表知Sn和C在同一主族,所以最高正价为+4;Cl位于VIIA,最高化合价为+7价,Cl最高价氧化物对应水化物的化学式为HClO4;Bi位于VA,最高化合价为+5价,最高价氧化物的化学式为Bi2O5。答案:Bi2O5。
(3)①阴影部分元素包括F、Cl、Br、I,属于同一主族。因为HF分子间存在着氢键,形成的氢化物中沸点最高的是HF。答案:HF。
②因为非金属性As<Se,所以酸性H3AsO4<H2SeO4,答案:<。
③因为非金属性S<O,所以氢化物的还原性:H2O<H2S。答案:< 。
④因为原子半径N<P,P< Si,所以N< Si。答案:<。
(4)图中虚线部分为金属和非金属分界线,可以在附近寻找半导体材料。答案:B。
(5) C、Si的非金属性强弱顺序为C>Si,可以根据碳酸酸性强于硅酸来证明,化学反应中,强酸可以制得弱酸,即在试管中加入CaCO3固体,再加入盐酸,将生成气体通过饱和NaHCO3溶液洗气后,通入Na2SiO3溶液,生成白色胶状沉淀,则碳酸酸性强于硅酸,结论:非金属性C>Si。因此,本题正确答案是:在试管中加入CaCO3固体,再加入盐酸,将生成气体通过饱和NaHCO3溶液洗气后,通入Na2SiO3溶液;生成白色胶状沉淀,则碳酸酸性强于硅酸,即C的非金属性强于Si。


科目:高中化学 来源: 题型:
【题目】NH4HCO3在试管中加热,使放出的气体依次通过盛有足量过氧化钠的干燥管,足量浓H2SO4的洗气瓶,最后得到的气体是
A. NH3 B. H2O C. O2 D. O2和NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯佐卡因是人类合成的第一种麻醉药,从此人类摆脱了麻醉药依赖天然植物的历史。下面是苯佐卡因的一种合成路线:
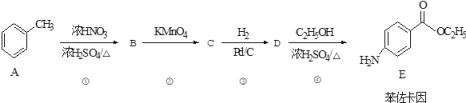
回答下列问题:
(1)物质B的结构简式为_______________,物质C的结构简式为 __________________。
(2)反应②的反应类型为______________,反应③的反应类型为 __________________。
(3)反应①的化学方程式为 ____________________________________________;反应④的化学方程式为____________________________________________。
(4)苯佐卡因的核磁共振氢谱中有____________个峰。
(5)苯佐卡因有多种同分异构体,除苯佐卡因外,符合下列条件的共有 _______种。
①含苯环且氨基直接与苯环相连;②苯环上有两个取代基;③含酯基
其中能与NaOH溶液反应生成2种钠盐的同分异构体的结构简式为:____________。(任写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当光束通过下列物质时,不会出现丁达尔效应的是( )
①氢氧化铁胶体 ②水 ③有尘埃的空气 ④蔗糖溶液 ⑤硫酸铜溶液
A.①②④B.①③⑤C.①③④D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期律和周期表的描述,正确的是( )
A.在元素周期表的右上方可以寻找制取半导体的元素
B.元素的性质随着原子序数的增加而呈现周期性变化
C.周期表中第ⅣA-ⅦA主族元素均可表现正化合价
D.同一主族元素的原子从上到下,原子半径减小,金属性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对废液进行处理(所加试剂均稍过量),以回收金属,保护环境。
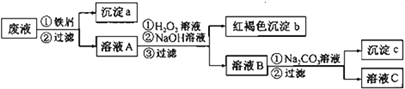
请回答:
(1)沉淀a中含有的单质是_____________。
(2)沉淀c的化学式是___________________。
(3)溶液A与H2O2溶液在酸性条件下反应的离子方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是有关FeSO4的转化关系 (无关物质已略去)。

已知:①X由两种化合物组成,将X通入品红溶液,溶液退色;通入BaCl2溶液,产生白色沉淀。②Y是红棕色的化合物。
(1) 气体X的成分是(填化学式)________。
(2) 反应Ⅰ的反应类型属于(填序号)________。
a.分解反应 b.复分解反应 c.置换反应 d.化合反应 e.氧化还原反应
(3) 溶液2中金属阳离子的检验方法是____________________________________________。
(4) 若经反应Ⅰ得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol·L-1 NaOH溶液完全吸收,则反应Ⅰ的化学方程式是_______________________________________________,
反应Ⅳ中生成FeSO4的离子方程式是_____________________________________________。
(5) 一瓶长期露置在空气中的FeSO4溶液,为检验其是否完全变质,则需要的试剂是___________(填写名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com