
【题目】NH4HCO3在试管中加热,使放出的气体依次通过盛有足量过氧化钠的干燥管,足量浓H2SO4的洗气瓶,最后得到的气体是
A. NH3 B. H2O C. O2 D. O2和NH3
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是( )
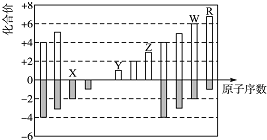
A. 原子半径:X<Y<Z
B. 气态氢化物的稳定性及其水溶液的酸性:R>W
C. W、X形成的化合物以及它们与水反应生成物都是共价化合物
D. Y、Z、W的最高价氧化物对应的水化物两两之间都能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Science杂志在2017 年报道了世界上首个成功合成的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(白色固体),这是全氮含能材料里程碑式的突破。该盐结构如图,下列分析不合理的是
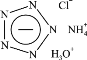
A. 五氮阴离子的化学式为N5—
B. 该盐中阴阳离子数目之比为 ![]()
C. 该盐在碱中比在酸中稳定
D. 该盐存在离子键和共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①Na2S、②金刚石、③NH4Cl、④Na2SO4、⑤干冰、⑥碘片六种物质,按下列要求回答:
(1)熔化时不需要破坏化学键的是____________,熔化时需要破坏共价键的是____________,熔点最高的是____________,熔点最低的是_____________(填序号)。
(2)属于离子化合物的是_______________________,只有离子键的物质是____________,以分子间作用力结合的物质是____________________(均填序号),③的电子式____________________。
(3)用电子式表示①的形成过程是______________________,用电子式表示⑥的形成过程是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已学知识,请回答下列问题:
(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有______种。
(2)画出第四周期的第ⅠB族元素基态原子电子排布式:____________________。
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是_________。
(4)在极性分子NCl3中,N原子的化合物为―3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是_______________(填化学式)。
(5)第ⅢA族的元素由于最外能层的p能级中有空轨道,故称为缺电子元素。硼酸的结构式可表示为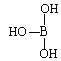 ,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:_______________________________。
,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:_______________________________。
(6)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式:(各写一种)正四面体分子_________,三角锥形分子 _________ 。
(7)钛被称为未来金属,已知某钛的化合物TiCl3·6H2O(相对分子质量为262.5)配位数为6,取该晶体26.25克配成溶液,加入足量硝酸银溶液,过滤,洗涤,烘干,称重,沉淀为28.70克,则该晶体的化学式可表示为______________________________。
(8)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为_____________;若两种 晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为____________。
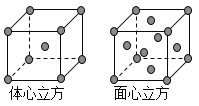
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两种物质作用时,反应条件(温度、反应物用量等)改变,不会引起产物改变的是
A. NaOH和CO2 B. Fe粉在Cl2中燃烧
C. Na和O2 D. NaOH容液和AlCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.100mol/L的NaOH溶液滴定10.00mL浓度均为0.100mol/L的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是
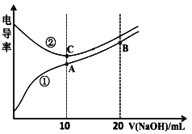
A. 曲线①代表滴定CH3COOH溶液的曲线
B. A、C两点对应溶液均呈中性
C. B点溶液中:c(Na+) > c(OH-) > c(CH3COO-)
D. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.050mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。下图是元素周期表的一部分,回答下列问题:

(1)元素Ga在元素周期表中的位置为:______________。
(2)Sn的最高正价为________,Cl的最高价氧化物对应水化物的化学式为________,Bi的最高价氧化物的化学式为________。
(3)根据元素周期律,推断:
①阴影部分元素形成的氢化物中沸点最高的是________。
②H3AsO4、H2SeO4的酸性强弱为:H3AsO4________H2SeO4(填“>”、“<”、“=”或“无法比较”)。
③氢化物的还原性:H2O________H2S(填“>”、“<”、“=”或“无法比较”)。
④原子半径比较:N________Si(填“>”、“<”、“=”或“无法比较”)。
(4)可在图中分界线(虚线部分)附近寻找________(填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料 D.农药
(5)若比较C、Si的非金属性强弱,请从下列试剂中选择最佳试剂组合进行实验, 请写出实验过程:(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液) _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述正确的是( )
A.任何物质里都含有化学键
B.离子化合物中可能含有共价键
C.共价化合物分子中可能含有离子键
D.水分子中氢、氧原子间的化学键是非极性键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com