
【题目】二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)ClO2可将废水中的CN-氧化成CO2和N2,该反应的离子方程式是_______。
(2)根据文献资料,用NaClO3和双氧水在酸性条件下可制得ClO2。某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。
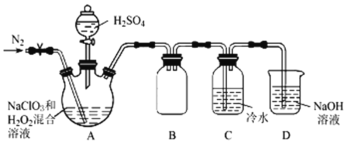
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是________。
②装置B的作用是__________________。
③装置A用于生成ClO2气体,该反应的化学方程式是_____。
(3)测定装置C中ClO2溶液的浓度:取10.00 mL C中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入____________作指示剂,用0.1000 mol·L-1的Na2S2O3标准液滴定锥形瓶中的溶液(I2 + 2S2O32-=2I-+ S4O62-),消耗标准溶液的体积为20.00 mL。滴定终点的现象是________,C中ClO2溶液的浓度是__________mol·L-1。
【答案】2ClO2 + 2CN-=2CO2 + N2 + 2Cl- 稀释二氧化氯,防止二氧化氯的浓度过高而发生爆炸或防倒吸 防止倒吸(或作安全瓶) 2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O 淀粉溶液 当滴入最后一滴标准溶液,溶液蓝色褪去且半分钟内不恢复原色 0.04000 mol/L
根据关系式:2ClO2~5I2~10Na2S2O3,
则n(ClO2)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() ×0.1000mol/L×0.02L=0.0004mol,据此计算可得。
×0.1000mol/L×0.02L=0.0004mol,据此计算可得。
【解析】
根据电子得失守恒和质量守恒书写(1)和③的离子方程式和化学方程式,用NaClO3和双氧水在酸性条件下可制得ClO2,装置A发生装置,产生ClO2,装置B是安全瓶作用,装置C收集ClO2,装置D尾气吸收,避免污染环境,测定装置C中ClO2溶液的浓度,应根据2ClO2~5I2~10Na2S2O3关系式,据此计算。
(1)ClO2可将废水中的CN-氧化成CO2和N2,ClO2自身被还原为Cl-,则ClO2中氯元素由+4价得5e-变成Cl-,CN-中碳元素由+2价失2e-变+4价,氮元素由-3价失3e-变0价,由电子得失守恒和质量守恒可写出离子反应式为:2ClO2+2CN-=2CO2+N2+2Cl-;答案为2ClO2+2CN-=2CO2+N2+2Cl-;
(2)①氮气可以搅拌混合液,使其充分反应,还可以稀释二氧化氯,防止因二氧化氯的浓度过高而发生爆炸;答案为稀释二氧化氯,防止因二氧化氯的浓度过高而发生爆炸;
②已知二氧化氯易溶于水,则装置B防止倒吸(或作安全瓶);答案为防止倒吸(或作安全瓶);
③装置A用于生成ClO2气体,NaClO3中氯元素化合价由+5价得e-变成+4价,H2O2中氧元素由-1价失e-变成0价,根据电子得失守恒和质量守恒可写出该反应的化学方程式为2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O;答案为:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O;
(3)根据滴定原理,KI在酸性条件下被ClO2氧化为I2,反应为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O,故选用淀粉溶液做指示剂;用Na2S2O3标准液滴定锥形瓶中的I2,当滴入最后一滴标准液时,锥形瓶内溶液蓝色褪去且半分钟内不恢复原色,说明达到滴定终点;根据2ClO2+10I-+8H+=2Cl-+5I2+4H2O和I2 + 2S2O32-=2I-+ S4O62-可知:2ClO2~5I2~10Na2S2O3,则n(ClO2)= ![]() n(Na2S2O3)=
n(Na2S2O3)= ![]() ×0.1000mol/L×0.02L=0.0004mol,C中ClO2溶液的浓度是c(ClO2)=
×0.1000mol/L×0.02L=0.0004mol,C中ClO2溶液的浓度是c(ClO2)= ![]() =0.04mol/L;答案为淀粉溶液,当滴入最后一滴标准液时,锥形瓶内溶液蓝色褪去且半分钟内不恢复原色,说明达到滴定终点,0.04mol/L。
=0.04mol/L;答案为淀粉溶液,当滴入最后一滴标准液时,锥形瓶内溶液蓝色褪去且半分钟内不恢复原色,说明达到滴定终点,0.04mol/L。


科目:高中化学 来源: 题型:
【题目】mA(g)+nB(g)![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是
pC(g)的速率和平衡的影响图像如下,下列判断正确的是
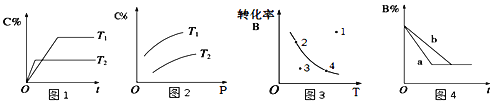
A.由图1可知,T1<T2,该反应正反应为吸热反应
B.由图2可知,该反应m+n﹤p
C.图3中,表示反应速率v正>v逆的是点3
D.图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国传统中药金银花具有清咽润喉、增强免疫调节的作用,其中的一种有效成分为绿原酸,结构简式如下图所示:
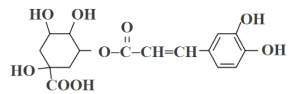
回答下列问题:
(1)绿原酸的分子式为_______________。
(2)1mol绿原酸能与_______molNaOH完全反应,1mol绿原酸能与______molH2完全加成。
(3)咖啡豆中含有绿原酸,烘焙手法对咖啡风味的影响可以用下图解释:
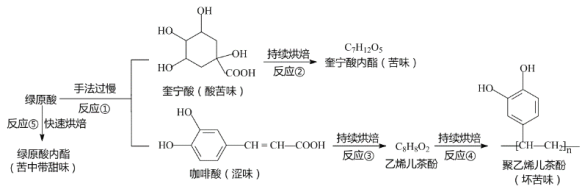
①上述反应中属于酯化反应的是___________(填序号)。
②写出乙烯儿茶酚(C8H8O2)的结构简式____________。
③写出反应③的方程式______________。
④写出符合下列要求的乙烯儿茶酚的同分异构体结构简式______________。
I.苯环上有两个取代基 II.能够与碳酸氢钠反应生成气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅藻土是由无定形SiO2组成的,含有少量Fe2O3、Al2O3及有机物等杂质,通常呈浅黄色或浅灰色,质软多孔。工业上可按如图所示流程,用硅藻土制备纳 米级二氧化硅。
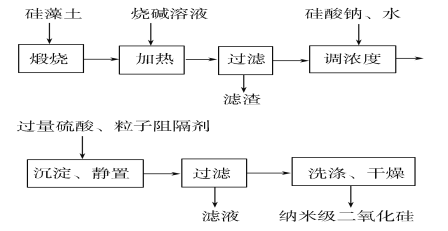
请回答下列问题:
(1)煅烧硅藻土的目的是___________。
(2)在加热条件下加入烧碱溶液时,发生反应的化学方程式为___________、__________。
(3)加入过量硫酸后,生成沉淀的离子方程式为_________。
(4)若用纳米级二氧化硅制成水溶液,则该溶液所具有的性质与下列图片有关的是________(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述不正确的是![]()
选项 | 已知 | 解释与结论 |
A | 活泼金属Al、不活泼金属Cu和浓硝酸可以形成原电池 | Al作正极,Cu作负极 |
B |
该反应在常温下能自发进行 | 该反应的 |
C | 常温下,
| 向 |
D | 向 | 氧化性: |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反应时 NO和CO各为 4 mol,10 秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反应时 NO和CO各为 4 mol,10 秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
A. 反应前5秒钟内,用NO表示的平均反应速率为0.lmol·L-1·s-1
B. 达到平衡后,升髙温度,正反应速率将减小,逆反应速率将增大
C. 达到平衡后,反应速率的关系有:V正(CO)=2v逆(N2)
D. 保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.利用甲烷催化还原NOx消除氮氧化物的污染
①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ·mol-1
②CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160kJ·mol-1
③CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) ΔH3=-867kJ·mol-1
N2(g)+CO2(g)+2H2O(g) ΔH3=-867kJ·mol-1
(1)如果三个反应的平衡常数依次为K1、K2、K3,则K3=___(用K1、K2表示)。
(2)在2L恒容密闭容器中充入1molCH4和2molNO2进行反应③,CH4的平衡转化率α(CH4)与温度和压强的关系如图所示。
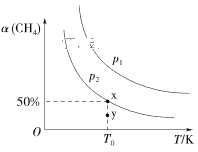
①若容器中的压强为p2,y点:v正____(填“大于”“等于”或“小于”)v逆。
②x点对应温度下反应的平衡常数K=___。
Ⅱ.甲烷蒸气转化法制H2的主要反应为:CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
(3)在恒容密闭容器中充入2 mol CH4和H2O(g)的混合气体,且CH4和H2O(g)的物质的量之比为x,相同温度下达到平衡时测得H2的体积分数φ(H2)与x的关系如图所示。
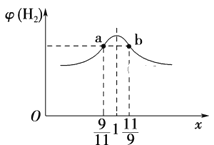
则CH4的转化率:a点____(填“>”“=”或“<”,下同)b点,CH4(g)的浓度:a点_____b点,氢气的产率:a点____b点。
Ⅲ.(4)根据以下三个热化学方程式:2H2S(g)+3O2(g)=SO2(g) +2H2O(l) ΔH=-Q1kJ·mol-1,2H2S(g)+O2(g)= S(s)+2H2O(l) ΔH=-Q2kJ·mol-1,2H2S(g)+O2(g)= S(s)+2H2O(g) ΔH=-Q3kJ·mol-1,判断Q1、Q2、Q3的大小关系是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似pH,是指稀溶液中溶质物质的量浓度的负对数。如某溶液溶质的浓度为1×10-3mol/L,则该溶液中溶质的pC=3。下列叙述正确的是
A.某温度下,任何电解质的稀溶液中,pC(H+)![]() pC(OH-)
pC(OH-)![]()
B.0.01mol/L的CaCl2溶液中逐滴加入纯碱溶液,滴加过程中pC(Ca2+)逐渐增大
C.0.01mol/L的BaCl2溶液中,pC(Cl-)![]() 2pC(Ba2+)
2pC(Ba2+)
D.用0.01mol/L的盐酸滴定某浓度的NaOH溶液,NaOH溶液的pC(OH-)逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl22H2O的流程如下:
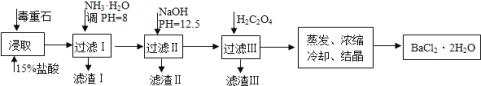
(1)写出“浸取”环节发生的主要离子方程式______。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的______。(双选,填选项字母)
a.烧杯b.容量瓶c.滴定管d.玻璃棒
(2)下图是一些难溶氢氧化物在不同pH下的沉淀一溶解图
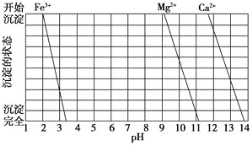
已知:Ksp(BaC2O4)= 1.6×10-7, Ksp(CaC2O4)= 2.3×10-9,
①滤渣I中含_____(填化学式)。再加入NaOH调节pH=12.5可除去______(填离子符号)
②加入H2C2O4应避免过量的原因是________
(3)25℃,H2C2O4的电离平衡常数如下:
H2C2O4 | Ka1=5.36×10-2 | Ka2=5.35×10-5 |
①HC2O4-的电离平衡常数表达式Ka2=__________
②NaHC2O4溶液呈_______(酸性、碱性、中性)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com