
【题目】下列说法正确的是( )
A、同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同
B、已知甲烷的标准燃烧热为ΔH=-890.3 kJ/mol 则甲烷燃烧热的热化学方程式为:CH4 (g) + 2O2 (g) = CO2(g) + 2H2O(g) ΔH=-890.3 kJ/mol
C、一定条件下,0.5 mol N2 和1.5 mol H2在密闭容器中充分反应生成NH3,放热19.3 kJ,其热化学方程式为:N2 (g)+ H2 (g)![]() 2NH3(g) ΔH =-38.6 kJ/mol
2NH3(g) ΔH =-38.6 kJ/mol
D、2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l)ΔH=-57.3kJ/mol
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】化学反应A2+ B2= 2AB的能量变化如图所示,则下列说法正确的是( )

A. 该反应是吸热反应
B. 断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量
C. 断裂2 mol A—B键需要吸收y kJ的能量
D. 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素中,在生物体内含量极少,但对维持生物体正常活动必不可少的一组是( )
A. Fe、Mn、Zn、Mg B. Zn、Cu、Mg、Ca
C. Zn、Cu、B、Mn D. S、Mn、Cu、Mo
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2(g)与H2(g)在铁催化剂表面经历如右过程生成NH3(g):
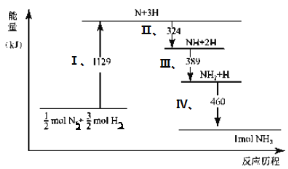
下列说法正确的是( )
A.Ⅰ中1129KJ为该反应过程的活化能
B.N2(g)+3H2(g)![]() 2NH3(g) ΔH=2(324+389+460-1129)kJ/mol
2NH3(g) ΔH=2(324+389+460-1129)kJ/mol
C.Ⅱ、Ⅲ、Ⅳ均为放热过程
D.N2(g)+3H2(g)![]() 2NH3(g)ΔH>0
2NH3(g)ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过石油裂解制得A。以A为原料制取有机玻璃N及隐形眼镜材料M的合成路线如下:
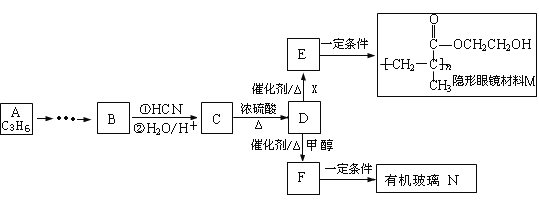
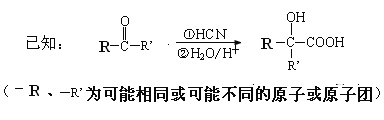
请回答:
(1)A中官能团的名称是 ,B的结构简式是 ,X中核磁共振氢谱峰面积比是 。
(2)F→N反应的化学方程式是 ,反应类型是 。
(3)C在一定条件下转化为高分子化合物的化学方程式是 。
(4)D有多种同分异构体,符合下列条件的有 种(包括顺反异构体)。
① 能发生银镜反应 ② 能与NaOH溶液反应
其中反式结构的结构简式是 。
(5)B是一种重要的工业溶剂,请完成A→B的反应的合成路线 (有机物写结构简式、无机试剂任选): 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论不正确的是

A.容器中发生的反应可表示为:3X(g)+Y(g) ![]() 2Z(g)
2Z(g)
B.反应进行的前3 min内,用X表示的反应速率 v(X)=0.3mol/(L·min)
C.据图2可知,相对于T1,温度为T2时更快达到“拐点”,说明T2时化学反应速率更快,可确定温度T2高于T1
D.若改变反应条件,使反应进程如图3所示,则改变的条件可能是使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】熔融盐燃料电池具有高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:2C4H10+26CO32--52e- =34CO2+10H2O。
试回答下列问题:
(1)该燃料电池的化学反应方程式为 ;
(2)正极电极反应式为 。
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是 ,它来自 。
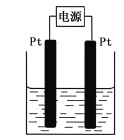
(4)某学生想用该燃料电池和右图所示装置来电解饱和食盐水
①写出反应的离子方程式 。
②将湿润的淀粉KI试纸放在该装置附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5:1,且生成两种酸。该反应的化学方程式为 。
③若电解后得到200mL 3.25mol/LNaOH溶液,则消耗C4H10 的体积在标准状况下为 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学研究中,往往可以通过观察现象认识物质变化的情况。请分析以下一组有现象变化的化学反应。

(1)用离子方程式解释现象I中出现胶状沉淀的原因: 。
(2)II中加碱时出现的现象是 ,此现象说明溶液中发生反应的离子方程式是 。
(3)III中加碱时出现的现象是 。
(4)用离子方程式解释IV中加碱时出现的现象: 。
(5)滴加试剂顺序的变化,会影响溶液中的现象和发生的反应,请继续分析以下实验。
实验 | 试剂及操作 | 现象 | |
试管 | 滴管 | ||
1.0 mL | 0.1 mol·L1 Fe(NO3)2溶液 | 先滴加1.5 mL 1.0 mol·L1 H2SO4溶液; 再滴加1.0 mL 0.5 mol·L1 NaOH溶液 | V.加酸时溶液无明显现象;加碱后溶液依然没有明显变化 |
①探究加酸时Fe(NO3)2溶液中是否发生了反应:向1.0 mL 0.1 mol·L1 Fe(NO3)2溶液中 ,溶液立即变红,说明溶液中含Fe3+,证明加酸时溶液中发生了反应。
② 推测溶液中产生Fe3+的可能原因有两种:
a.酸性条件下,0.1 mol·L1 Fe(NO3)2溶液中的Fe2+被NO3-氧化;
b. (用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源可分为一级能源和二级能源,自然界中以现成形式提供的能源称为一级能源,需依靠其他能源间接制取的能源称为二级能源。比如氢气就是一种高效而没有污染的二级能源。据此判断,下列叙述正确的是( )
A.天然气是二级能源 B.石油是二级能源
C.焦炉煤气是一级能源 D.煤是一级能源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com