

分析 (1)二氧化碳在水中溶解度较小,而氨气极易溶于水,据此判断通入气体的先后顺序;
(2)苦卤中通入氯气,氯气氧化溴离子为溴单质,通入热的空气吹出溴单质,在吸收塔中用碳酸钠溶液吸收生成溴酸钠和溴化钠,再加入稀硫酸酸化,重新获得含Br2的溶液,富集溴元素,提高溴单质的浓度,得到的粗溴进入蒸馏塔,向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏得到液溴,
①吸收塔中碳酸根离子与溴单质反应生成溴离子、溴酸根离子和二氧化碳气体,据此写出反应的离子方程式;
②氯气具有氧化性,能氧化溴离子为溴单质,在①中溴单质浓度较小,通过吹出、吸收、酸化重新获得含Br2的溶液,可以富集溴,降低成本;
③温度过高会导致水蒸气蒸发出来,温度过低无法将溴蒸发出来.
解答 解:(1)由于二氧化碳在水中溶解度较小,而NH3易溶于水,且水溶液显碱性,有利于充分吸收CO2,增大溶液中碳酸氢根的浓度,所以向饱和的氯化钠溶液中先通入氨气,再通入二氧化碳,
故答案为:NH3;NH3易溶于水,且水溶液显碱性,有利于充分吸收CO2,增大溶液中碳酸氢根的浓度;
(2)①纯碱是碳酸钠,与溴反应有BrO3-生成,则分数的是氧化还原反应,溴元素化合价0价升高为+5价,降低为-1价,依据电子守恒配平书写,反应的离子方程式为:3CO32-+3Br2=5Br-+BrO3-+3CO2↑,
故答案为:3CO32-+3Br2=5Br-+BrO3-+3CO2↑;
②通过①氯化已获得含Br2的溶液,是利用氯气的氧化性氧化溴离子为溴单质,反应的离子方程式为:2Br-+Cl2=Br2+2Cl-,利用氯气的氧化性从①出来的溶液中溴的含量不高,如果直接蒸馏,产品成本高,所以需要进一步浓缩溴,提高溴的浓度,
故答案为:2Br-+Cl2=Br2+2Cl-;富集溴,提高Br2的浓度;
③温度过高水蒸气蒸出,溴中含有水分,温度过低溴不能完全蒸出,产率低,所以控制温度在90℃左右进行蒸馏的原因是顺利将溴蒸出,同时防止水馏出,
故答案为:顺利将溴蒸出,同时防止水馏出.
点评 本题考查海水的综合利用、纯碱制备的工业原理、从海水中提溴的流程等知识,题目难度中等,明确生成流程为解本题关键.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 它有利于儿童牙齿的生长 | |
| B. | 它有利于骨骼的生长和发育 | |
| C. | 它有利于化合物Ca10(PO4)6(OH)2的生成 | |
| D. | 它使儿童更聪明 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 118号元素的相对原子质量为293 | |
| B. | 118号元素的一种同位素${\;}_{118}^{293}$Pb的质量数为293 | |
| C. | 118号元素的一种同位素${\;}_{118}^{293}$Pb的中子数为293 | |
| D. | 118号元素应为周期表中第8周期的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S原子的电子层数比Cl原子的电子层数多 | |
| B. | Cl的氢化物的沸点比S的氢化物沸点低 | |
| C. | Cl的气态氢化物比S的气态氢化物稳定 | |
| D. | Cl的失电子能力比S强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2+是XO4-的还原产物 | |
| B. | 溶液中可发生:Z2+2A2+═2A3++2Z- | |
| C. | 氧化性强弱的顺序为:XO4->B2>Z2>A3+ | |
| D. | Z2在①中是氧化产物,③中是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
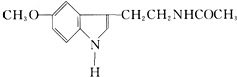
| A. | 它属于芳香族化合物 | B. | 它属于高分子化合物 | ||
| C. | 分子式为C13N2H16O2 | D. | 在一定条件下可以发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com