
| A. | F的原子结构示意图: | |
| B. | CH3CH2COOH:从分类角度看该物质属于羧酸 | |
| C. | 次氯酸的电子式: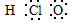 | |
| D. | 壬烷和癸烷,丁烷和新戊烷均为同系物 |
分析 A、氟原子的核内有9个质子,核外有9个电子;
B、-COOH连在链烃基或苯环侧链上的物质属于羧酸;
C、次氯酸是共价化合物,氧原子与氢原子、氯原子分别通过1对共用电子对结合;
D、结构相似,在分子组成上相差一个或若干个CH2原子团的化合物互为同系物.
解答 解:A、氟原子的核内有9个质子,核外有9个电子,故F原子的结构示意图为 ,故A正确;
,故A正确;
B、-COOH连在链烃基或苯环侧链上的物质属于羧酸,则CH3CH2COOH属于羧酸类,故B正确;
C、次氯酸是共价化合物,氧原子与氢原子、氯原子分别通过1对共用电子对结合,结构式为H-O-Cl,故电子式为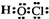 ,故C错误;
,故C错误;
D、结构相似,在分子组成上相差一个或若干个CH2原子团的化合物互为同系物,而壬烷和癸烷,丁烷和新戊烷均属于烷烃,故结构相似,在分子组成上分别相差1个CH2原子团,故互为同系物,故D正确.
故选C.
点评 本题考查了原子结构示意图、电子式的书写和同系物的判断等问题,应注意的是互为同系物的物质必须结构相似,即必须属于同一类物质,且含有的官能团的种类、个数均相同.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 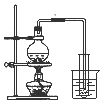 制取少量蒸馏水 | B. |  制取少量NO2 | ||
| C. | 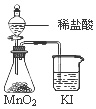 比较MnO2、Cl2、I2的氧化性 | D. |  量取8.50mL的 稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入CO2气体产生蓝色沉淀 | |
| B. | 该溶液中Na+、NH4+、NO3-、Mg2+可以大量共存 | |
| C. | 与H2S反应的离子方程式:Cu2++S2-=CuS↓ | |
| D. | 与过量浓氨水反应的离子方程式:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在家用燃煤中加人适量的生石灰能有效减少二氧化硫的排放量 | |
| B. | 利用太阳能、潮汐能、风力发电,以获取清洁能源 | |
| C. | 采用纳米二氧化钛光触媒技术.将汽车尾气中的NO和CO转化为无害气体 | |
| D. | 大量排放SO2,NO2或CO2都会导致酸雨的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 序号 | 反应 | 平衡常数 |
| 1 | Au+6HNO3(浓)═Au(NO3)3+3NO2↑+3H2O | <<1 |
| 2 | Au3++4Cl-═AuCl4- | >>1 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  此图表示可用蒸馏法分离X、Y | B. |  SO2气体通入溴水中 | ||
| C. |  氨气通入醋酸溶液中 | D. | 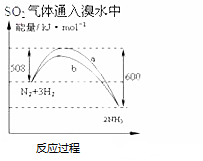 N2(g)+3H2(g)═2NH3(g)△H=-92KJmol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L苯中含有分子数目为0.5NA | |
| B. | 常温下,1.8g水中含有的电子数为NA | |
| C. | 0.1 mol Cl2与足量氢氧化钠溶液反应,转移的电子数为0.2NA | |
| D. | 1L0.1mol/L的NH4CL溶液中含NH4+的数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com