
| A. |  此图表示可用蒸馏法分离X、Y | B. |  SO2气体通入溴水中 | ||
| C. |  氨气通入醋酸溶液中 | D. | 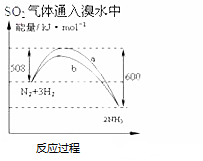 N2(g)+3H2(g)═2NH3(g)△H=-92KJmol |
分析 A.蒸馏法是利用物质熔沸点不同通过加热冷凝分离两种液体的方法;
B.溴水溶液中含有溴化氢,溴化氢为强酸,电离的产生氢离子,溶液显酸性;
C.氨气通入醋酸反应生成一水合氨,结合电解质导电强弱与自由移动离子浓度大小有关解答;
D.依据图示可知,反应物总能量高于生成物,反应放热,依据图示计算反应热,书写热化学方程式.
解答 解:A.依据图示可知,两种物质溶解度随着温度变化趋势不同,可以用降温结晶法分离,故A错误;
B.溴水溶液中含有溴化氢,溴化氢为强酸,电离的产生氢离子,溶液显酸性,所以开始溶液pH值应小于7,故B错误;
C.醋酸为弱酸,部分电离,通入氨气后反应生成醋酸铵,醋酸铵为强电解质,完全电离,产生自由移动离子浓度增大,所以导电能力增强,与图示不符,故C错误;
D.依据图示可知,反应物总能量高于生成物,反应放热,1mol氮气与3mol氢气完全反应生成2mol氨气,放出热量:600KJ-508KJ=92KJ,所以反应的热化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92KJmol,故D正确;
故选:D.
点评 本题为图象题,准确理解图象含义,熟悉常见分离物质方法及原理,明确电解质溶液导电性强弱原因,热化学方程式书写方法是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F的原子结构示意图: | |
| B. | CH3CH2COOH:从分类角度看该物质属于羧酸 | |
| C. | 次氯酸的电子式: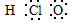 | |
| D. | 壬烷和癸烷,丁烷和新戊烷均为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| B. | 60 g SiO2含有的化学键数目为4NA | |
| C. | CO2通过Na2O2使其增重a g时,反应中转移的电子数为aNA/56 | |
| D. | 常温常压下,14.9 g KCl与NaClO的固体混合物中阴离子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{2}$、$\frac{1}{22.4}$ | B. | $\frac{1}{3}$、$\frac{1}{33.6}$ | C. | $\frac{2}{3}$、$\frac{1}{11.2}$ | D. | $\frac{3}{4}$、$\frac{1}{22.4}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 金属 质量/g | 金属状态 | c(H2SO4) /mol•L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
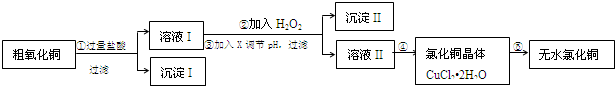
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 7.0 | 9.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com