
| �������↑ʼ����ʱ��pH | �������������ȫʱ��pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 7.0 | 9.0 |
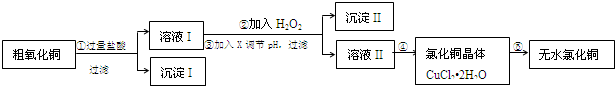
���� ��CuO�к���FeO�Ͳ�����������ʣ�����CuO���ڹ������ᣬ�����ķ�Ӧ��FeO+2HCl=FeCl2+H2O��CuO+2HCl=CuCl2+H2O��Ȼ����ˣ��õ�����IΪ������������ʣ���ҺI������ΪFeCl2��CuCl2��HCl������ҺI�м���X��YȻ�����pH���ˣ��õ�����II����ҺII����ȥFeCl2��CuCl2��HCl�е�FeCl2�������������������Ҫ��pH֪��Ӧ���Ƚ�FeCl2����Ϊ���Σ�Ϊ�������µ����ʣ�������XӦ��ΪCl2��H2O2��Ȼ������Һ�м���CuO������Һ��pH������Y������CuO�������IIΪFe��OH��3��Ȼ����ҺII����Ũ������ȴ�ᾧ�õ�CuCl2.2H2O�������HCl��Χ�м���CuCl2.2H2O�õ�CuCl2��
��1��������������ᷴӦ�����κ�ˮ��
��2������ڼ��������������������������������ӣ�Ȼ�������Һ��pH��ȥ�����ӣ�
��3������������ȫ����ʱ��Һ��pHΪ3.2����ͭ���ӳ��ֳ���ʱ��Һ��pHΪ4.7��������Һ��pHҪ��ȥ�����Ӷ����ܳ�ȥͭ���ӣ�
��4���Ȼ��������Ȼ�ͭ��ˮ�⣬�Ա�ﵽ�Ȼ�ͭ���壮
��� �⣺��CuO�к���FeO�Ͳ�����������ʣ�����CuO���ڹ������ᣬ�����ķ�Ӧ��FeO+2HCl=FeCl2+H2O��CuO+2HCl=CuCl2+H2O��Ȼ����ˣ��õ�����IΪ������������ʣ���ҺI������ΪFeCl2��CuCl2��HCl������ҺI�м���X��YȻ�����pH���ˣ��õ�����II����ҺII����ȥFeCl2��CuCl2��HCl�е�FeCl2�������������������Ҫ��pH֪��Ӧ���Ƚ�FeCl2����Ϊ���Σ�Ϊ�������µ����ʣ�������XӦ��ΪCl2��H2O2��Ȼ������Һ�м���CuO������Һ��pH������Y������CuO�������IIΪFe��OH��3��Ȼ����ҺII����Ũ������ȴ�ᾧ�õ�CuCl2.2H2O�������HCl��Χ�м���CuCl2.2H2O�õ�CuCl2��
��1��ͨ�����Ϸ���֪��CuO���ᷴӦ����ͭ�κ�ˮ�����ӷ���ʽΪCuO+2H+=Cu2++H2O���ʴ�Ϊ��CuO+2H+=Cu2++H2O��
��2������ڼ��������������������������������ӣ�Ȼ�������Һ��pH��ȥ�����ӣ�ѡȡ˫��ˮʱ���������ӷ�ӦΪ2Fe2++H2O2+2H+=2Fe3++2H2O���ʴ�Ϊ��2Fe2++H2O2+2H+=2Fe3++2H2O��
��3������������ȫ����ʱ��Һ��pHΪ3.2����ͭ���ӳ��ֳ���ʱ��Һ��pHΪ4.7��������Һ��pHҪ��ȥ�����Ӷ����ܳ�ȥͭ���ӣ�������Һ��pH��ΧΪ3.2-4.7��������ҺpHʱ���������µ����ʣ�����Լ���CuO�� Cu��OH��2����ѡ��bc���ʴ�Ϊ��3.2-4.7��bc��
��4���Ȼ�ͭˮ�⣬�ڸ����HCl����������Cu2+��ˮ�⣬�Ҵ���CuCl2•xH2O���Ȳ�����ˮ�������ܵõ���ˮ�Ȼ�ͭ��
�ʴ�Ϊ���ڸ����HCl����������Cu2+��ˮ�⣬�Ҵ���CuCl2•xH2O���Ȳ�����ˮ�������ܵõ���ˮ�Ȼ�ͭ��
���� ���⿼������ķ�����ᴿ���漰���Ӽ���ѡȡ��������ԭ��Ӧ��������ѡȡ��֪ʶ�㣬���ؿ����������������������������������ѡȡ�������ѵ���ȷ��������Һ��pHʱpH��ȡֵ��Χ����Ŀ�Ѷ��еȣ�


 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͨ��CO2���������ɫ���� | |
| B�� | ����Һ��Na+��NH4+��NO3-��Mg2+���Դ������� | |
| C�� | ��H2S��Ӧ�����ӷ���ʽ��Cu2++S2-=CuS�� | |
| D�� | �����Ũ��ˮ��Ӧ�����ӷ���ʽ��Cu2++2NH3•H2O=Cu��OH��2��+2NH4+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ��� | ��Ӧ | ƽ�ⳣ�� |
| 1 | Au+6HNO3��Ũ���TAu��NO3��3+3NO2��+3H2O | ����1 |
| 2 | Au3++4Cl-�TAuCl4- | ����1 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ��ͼ��ʾ����������X��Y | B�� |  SO2����ͨ����ˮ�� | ||
| C�� |  ����ͨ�������Һ�� | D�� | 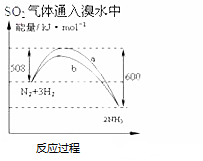 N2��g��+3H2��g���T2NH3��g����H=-92KJmol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
 ij��A���л���ѧ��ҵ�Ļ���ԭ�ϣ������������������һ�����ҵ�ʯ�ͻ�����չˮƽ��A����һ��ֲ���������ڼ���A�ɷ�����ͼ��ʾ��һϵ�л�ѧ��Ӧ�����Т٢ڢ�����ͬ�ַ�Ӧ���ͣ�
ij��A���л���ѧ��ҵ�Ļ���ԭ�ϣ������������������һ�����ҵ�ʯ�ͻ�����չˮƽ��A����һ��ֲ���������ڼ���A�ɷ�����ͼ��ʾ��һϵ�л�ѧ��Ӧ�����Т٢ڢ�����ͬ�ַ�Ӧ���ͣ� ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��������������������й㷺��;��
��������������������й㷺��;���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�11.2L���к��з�����ĿΪ0.5NA | |
| B�� | �����£�1.8gˮ�к��еĵ�����ΪNA | |
| C�� | 0.1 mol Cl2����������������Һ��Ӧ��ת�Ƶĵ�����Ϊ0.2NA | |
| D�� | 1L0.1mol/L��NH4CL��Һ�к�NH4+����ĿΪ0.1NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C16H22O5 | B�� | C14H16O4 | C�� | C14H18O5 | D�� | C14H20O5 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com