
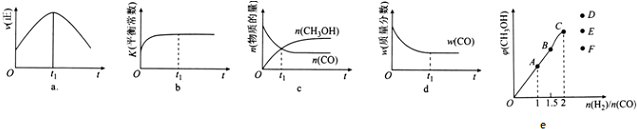
分析 (1)结合热化学方程式和盖斯定律计算,计算①+②×2-③得到CO(g)+2H2(g)?CH3OH(g)的热化学方程式;
(2)a、图1表示t1时刻如果达平衡,正反应速率不变;
b、平衡常数不变,说明体系的温度不变,而在绝热的体系中;
c、一氧化碳与甲醇的物质的量相等;
d、一氧化碳的质量分数不变,说明各物质的质量不变,反应达平衡状态;
(3)结合化学三行计算列式计算,反应速率为v(H2)=$\frac{△c}{△t}$,气体物质的量之比等于气体体积之比,平衡常数随温度变化,K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
(4)当容器中各物质的物质的量之比等于化学方程式计量数之比时,达到平衡状态时生成物的体积分数最大,所以当$\frac{n({H}_{2})}{n(CO)}$小于2,平衡时甲醇的体积分数逐渐增大,当$\frac{n({H}_{2})}{n(CO)}$大于2,平衡时甲醇体积分数减小;
(5)燃料原电池中,燃料失电子发生氧化反应为负极,通入氧气得到电子发生还原反应为正极,电解池中阴极被保护;
(6)根据信息:二氧化氯和甲醇反应,生成Cl-、CO2和水2,配平方程式即可;
解答 解:(1)①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H1=-283.0kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H2=-241.8kJ/mol
③CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H3=-192.2kJ/mol
盖斯定律计算①+②×2-③,得到CO(g)+2H2(g)?CH3OH(g)△H4=-574.4KJ/mol,
故答案为:-574.4KJ/mol;
(2)a、图1表示t1时刻如果达平衡,正反应速率不变,而不是随时间间改变而减小,故a错误;
b、充入1molCO、2molH2,生成生成物甲醇,放出热量,反应体系的温度升高,K减小,而不是增大,故b错误;
c、一氧化碳与甲醇的物质的量相等,而不是平衡状态,故c错误;
d、随着反应的进行,一氧化碳的质量减小,一氧化碳的质量分数不变,说明各物质的质量不变,反应达平衡状态,故d正确;
故选d,
故答案为:d;
(3)T1℃时,在一个体积为5L的恒容容器中充入1mol CO、2mol H2,经过5min达到平衡,CO的转化率为0.8,化学三行计算列式得到,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 0.2 0.4 0
变化量(mol/L) 0.16 0.32 0.16
平衡量(mol/L) 0.04 0.08 0.16
则5min内用H2表示的反应速率为v(H2)=$\frac{0.32mol/L}{5min}$=0.064mol/(L•min),
温度不变,T1℃时,在另一体积不变的密闭容器中也充入1mol CO、2mol H2,达到平衡时CO的转化率为0.7,转化率减小说明平衡左移,体积增大,T1℃时,CO(g)+2H2(g)?CH3OH(g)的平衡常数K=$\frac{0.16}{0.04×0.0{8}^{2}}$=625,
故答案为:0.064mol/(L•min);>;625;
(4)当容器中各物质的物质的量之比等于化学方程式计量数之比时,达到平衡状态时生成物的体积分数最大,所以当$\frac{n({H}_{2})}{n(CO)}$小于2,平衡时甲醇的体积分数逐渐增大,当$\frac{n({H}_{2})}{n(CO)}$大于2,平衡时甲醇体积分数减小,所以C点对应的甲醇的体积分数最大,当$\frac{n({H}_{2})}{n(CO)}$=2.5时,平衡时甲醇体积分数会降低,应选F点,
故答案为:F;
(5)燃料原电池中,甲醇失电子发生氧化反应,所以通入燃料甲醇的电极为负极,电极反应式为:CH3OH+8OH--6e-═CO32-+6H2O,该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,是利用铁闸做电解池阴极被保护,名称为:外加电源的阴极保护法,
故答案为:CH3OH+8OH--6e-═CO32-+6H2O;外加电源的阴极保护法;
(6)根据信息:二氧化氯和甲醇反应,生成Cl-、CO2和水2,所以反应方程式为:6ClO2+5CH3OH=6Cl-+5CO2+6H++7H2O,
故答案为:6ClO2+5CH3OH=6Cl-+5CO2+6H++7H2O;
点评 本题考查盖斯定律的应用、化学平衡影响因素分析、原电池和电解原理的分析应用等,比较综合,题目难度中等,侧重于考查学生的分析能力和对基础知识的综合应用能力.


科目:高中化学 来源: 题型:选择题
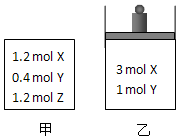 在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0.保持温度不变,测得平衡时的有关数据如表:下列说法正确的是( )
在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0.保持温度不变,测得平衡时的有关数据如表:下列说法正确的是( ) | 恒容容器甲 | 恒压容器乙 | |
| X的物质的量(mol) | n1 | n2 |
| Z的体积分数 | φ1 | φ2 |
| A. | 平衡时容器乙的容积一定比反应前小 | |
| B. | 平衡时容器甲的压强一定比反应前小 | |
| C. | n2>n1 | |
| D. | φ2<φ1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| B. | 60 g SiO2含有的化学键数目为4NA | |
| C. | CO2通过Na2O2使其增重a g时,反应中转移的电子数为aNA/56 | |
| D. | 常温常压下,14.9 g KCl与NaClO的固体混合物中阴离子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 金属 质量/g | 金属状态 | c(H2SO4) /mol•L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
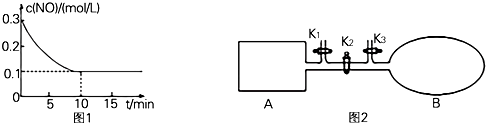
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 7.0 | 9.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com