
能说明元素X的原子得电子能力强于元素Y的原子的事实是( )
A.元素周期表中元素X位于元素Y的上一个周期
B.元素X的含氧酸的酸性强于元素Y的含氧酸
C.分别加热H2X、HY至500 ℃,只有HY发生分解
D.元素X与Y同主族,相同温度时其单质与铜反应分别生成Cu2X和CuY
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:2014高考化学二轮专题突破 专题十四常见有机物及其应用练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.1 mol葡萄糖水解能生成2 mol CH3CH2OH和2 mol CO2
B.向鸡蛋清中分别加入Na2SO4的浓溶液和CuSO4的浓溶液,都会因盐析而产生沉淀
C.油脂不是高分子化合物,1 mol油脂完全水解生成1 mol甘油和3 mol高级脂肪酸
D.欲检验蔗糖水解的产物是否具有还原性,可向其水解后的溶液中直接加入新制Cu(OH)2悬浊液并加热
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十三无机化学综合应用练习卷(解析版) 题型:实验题
氯气是一种重要的化工原料。某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
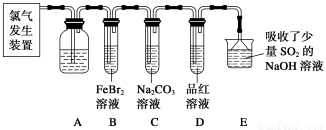
(1)实验室用二氧化锰和浓盐酸加热制取氯气,发生装置中除圆底烧瓶和导管外还需用到的玻璃仪器有__________________。
(2)装置A中盛有的试剂是________,作用是___________________________________。
(3)若D中品红溶液褪色,则B装置中发生反应的离子方程式是________________。
(4)证明FeBr2与Cl2发生了氧化还原反应的实验方法是__________(填操作方法)。
某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气。经分析吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32—和SO42—,对于可能存在的其他阴离子,研究小组提出以下3种假设。假设1:只存在SO32—;假设2:只存在ClO-;假设3:既不存在SO32—,也不存在ClO-。
(5)学习小组判断同时存在SO32—和ClO-是不可能的理由是_____________________。
(6)现限选以下试剂,设计实验方案,进行实验,请写出实验步骤以及预期现象和结论。
a.3 mol·L-1 H2SO4 b.0.01 mol·L-1 KMnO4
c.1 mol·L-1 BaCl2溶液 d.淀粉碘化钾溶液
e.酚酞试液
步骤一:取少量吸收液于试管中,滴加3 mol·L-1 H2SO4至溶液呈中性,然后将所得溶液分装于A、B两试管中。
步骤二:向A试管中滴加少量__________(填序号),若溶液____________________(填现象),则假设1成立。
步骤三:向B试管中滴加少量__________(填序号),若溶液____________________(填现象),则假设2成立。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十一常见金属元素练习卷(解析版) 题型:选择题
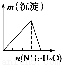
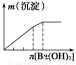
下列实验与对应示意图的关系正确的是( )
ABCD
NaAlO2溶液中逐滴滴加盐酸至过量AlCl3溶液中逐滴滴加氨水至过量 明矾溶液中逐滴滴加Ba(OH)2溶液至过量 澄清石灰水中缓慢通入CO2至过量
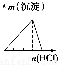
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十一常见金属元素练习卷(解析版) 题型:选择题
工业上冶炼金属一般用热分解法、热还原法和电解法,不同的金属应选用不同的冶炼方法。选择的原则主要是依据( )
A.金属在地壳中的丰度
B.金属在自然界中的存在形式
C.金属的还原性强弱
D.金属的利用价值
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题六物质结构和元素周期律练习卷(解析版) 题型:选择题
某矿石由前20号元素中的4种组成,其化学式为WmYnZpXq。X、Y、Z、W分布在三个周期,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,W单质能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,Y、Z位于同周期,Z单质是一种良好的半导体。下列说法正确的是( )
A.气态氢化物的稳定性:X<Z
B.含有1 mol Y的氯化物的水溶液中离子总数为4 mol(不考虑水的电离)
C.W位于第三周期ⅠA族,其原子半径比其他元素的都大
D.2 mol W单质和1 mol Y单质投入足量的水中会产生2.5 mol气体
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题八电化学练习卷(解析版) 题型:填空题
海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
含量/mg·L-1 | 9 360 | 83 | 200 | 1 100 | 16 000 | 1 200 | 118 |
(1)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过。
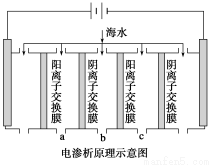
①阴极的电极反应式为__________________。
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式______________________________________。
③淡水的出口为a、b、c中的________出口。
(2)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如下图所示:
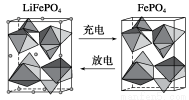
该电池电解质为传导Li+的固体材料。放电时该电极是电池的________极(填“正”或“负”),电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题五离子反应练习卷(解析版) 题型:选择题
水溶液中能大量共存的一组离子是( )
A.Na+、Al3+、Cl-、CO32- B.H+、Na+、Fe2+、MnO4-
C.K+、Ca2+、Cl-、NO3- D.K+、NH4+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题三溶液组成的计量及其应用练习卷(解析版) 题型:选择题
一定量的铜和浓硫酸在加热条件下充分反应,向反应后的溶液中逐滴加入含a mol NaOH的溶液,恰好使反应后的溶液呈中性,则下列叙述错误的是( )
A.溶液中c(Na+)=2c(SO42-)
B.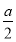 mol>沉淀的物质的量>0
mol>沉淀的物质的量>0
C.沉淀的物质的量=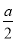 mol
mol
D.原浓硫酸中H2SO4的物质的量>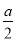 mol
mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com