
 25℃时,电离平衡常数:
25℃时,电离平衡常数:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
分析 (1)酸根离子对应的酸的酸性越强,酸根离子结合氢离子的能力越弱;
(2)酸性强弱为CH3COOH>H2CO3>HClO>HCO3-,强酸能够制取弱酸,据此对各选项进行判断;
(3)醋酸是弱电解质,加水稀释醋酸,促进醋酸电离,则n(CH3COO-)、n(H+)增大,n(CH3COOH)减小,但醋酸根离子、氢离子浓度增大的程度小于溶液体积增大的程度,所以c(CH3COO-)、c(H+)、c(CH3COOH)都减小,据此分析解答;
(4)加水稀释促进弱酸电离,pH相同的不同酸稀释相同的倍数,pH变化大的酸酸性强,变化小的酸酸性弱;酸或碱抑制水电离,酸中氢离子或碱中氢氧根离子浓度越大其抑制水电离程度越大.
解答 解:(1)电离平衡常数越大,越易电离,溶液中离子浓度越大,则酸性强弱为:CH3COOH>H2CO3>HClO>HCO3-,酸根离子对应的酸的酸性越强,酸根离子结合氢离子的能力越弱,则四种离子结合质子的能力由大到小的顺序是:CO32->ClO->HCO3->CH3COO-,即a>b>d>c,
故答案为:a>b>d>c;
(2)a.CO32-+CH3COOH═CH3COO-+CO2↑+H2O:碳酸的酸性小于CH3COOH,所以CH3COOH能够制取碳酸,该反应能够发生,故a错误;
b.ClO-+CH3COOH═CH3COO-+HClO:CH3COOH的酸性大于HClO,CH3COOH能够制取HClO,该反应能够发生,故b错误;
c.CO32-+HClO═CO2↑+H2O+ClO-:HClO的酸性小于碳酸,该反应无法发生,故c正确;
d.2ClO-+CO2+H2O═CO32-+2HClO:由于酸性H2CO3>HClO>HCO3-,则碳酸与次氯酸根离子反应只能生成碳酸氢根离子,不会生成CO32-,该反应不能发生,故d正确;
故答案为:cd;
(3)A.加水稀释醋酸促进醋酸电离,氢离子物质的量增大,醋酸分子的物质的量减小,所以$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$的比值减小,故A错误;
B.加水稀释醋酸促进醋酸电离,醋酸根离子物质的量增大,醋酸分子的物质的量减小,则$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的比值增大,故B正确;
C.加水稀释促进醋酸电离,但氢离子浓度减小,温度不变,水的离子积常数不变,所以$\frac{c({H}^{+})}{{K}_{W}}$的比值减小,故C错误;
D.加水稀释醋酸促进醋酸电离,氢离子浓度减小,温度不变,水的离子积常数不变,则氢氧根离子浓度增大,$\frac{c({H}^{+})}{c(O{H}^{-})}$的比值减小,故D错误;
故答案为:B;
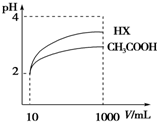
(4)加水稀释促进弱酸电离,pH相同的不同酸稀释相同的倍数,pH变化大的酸酸性强,变化小的酸酸性弱;酸或碱抑制水电离,酸中氢离子或碱中氢氧根离子浓度越大其抑制水电离程度越大,
根据图知,pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,则HX的酸性大于醋酸,所以HX的电离平衡常数大于常数,稀释后醋酸中氢离子浓度大于HX,所以醋酸抑制水电离程度大于HX,则HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来c(H+),
故答案为:大于;大于.
点评 本题考查酸碱混合溶液定性判断,为高频考点,题目难度中等,涉及离子浓度大小比较、pH的简单计算等知识,试题知识点较多、综合性较强,充分考查学生分析判断能力及化学计算能力.


科目:高中化学 来源: 题型:实验题
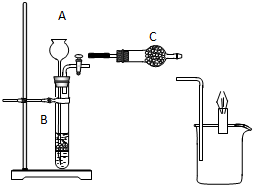 如图所示装置中,已知B中隔板上放的是石灰石,若当打开活塞时,烧杯中的蜡烛燃烧得更旺,请回答:
如图所示装置中,已知B中隔板上放的是石灰石,若当打开活塞时,烧杯中的蜡烛燃烧得更旺,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 | |
| B. | 与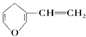 互为同分异构体的芳香族化合物有5种 互为同分异构体的芳香族化合物有5种 | |
| C. | 含有5个碳原子的饱和链烃,其一氯取代物有3种 | |
| D. | 菲的结构简式为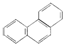 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水蒸发制海盐的过程中只发生了物理变化 | |
| B. | 加入明矾,使海水的盐分沉淀并淡化 | |
| C. | 海水淡化的方法主要有蒸馏法、离子交换法和电渗析法等 | |
| D. | 大海中含有钾、溴、碘等元素,需经过氧化还原反应才可得到钾、溴、碘的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ($\frac{b}{10}$-$\frac{a}{20}$) mol•L-1 | B. | (2b-a) mol•L-1 | C. | (5b-$\frac{5a}{2}$) mol•L-1 | D. | (10b-5a) mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
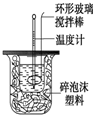 利用右图装置测定中和热的实验步骤如下:
利用右图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温 度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4℃ |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑥⑨⑩ | B. | ①③④⑦⑧⑨⑩ | C. | ①②③④⑦⑧⑨ | D. | ①②④⑤⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
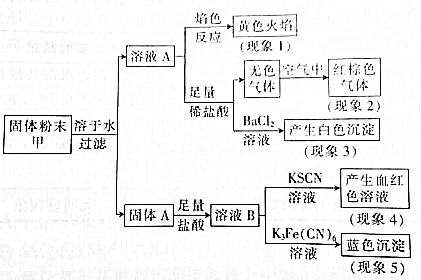
| A. | 根据现象1可推出该固体粉末中含有钠元素,可能含钾元素 | |
| B. | 根据现象2可推出该固体粉末中一定含有NaNO3 | |
| C. | 根据现象3可推出该固体粉末中一定含有Na2SO4 | |
| D. | 根据现象4和现象5可推出该固体粉末中一定含有FeO和Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

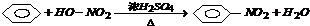 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com