
| A. | ①②③④⑥⑨⑩ | B. | ①③④⑦⑧⑨⑩ | C. | ①②③④⑦⑧⑨ | D. | ①②④⑤⑧⑨ |
分析 配制一定物质的量浓度的溶液的配制步骤为:计算、称量、溶解、移液、洗涤、定容、摇匀等,根据每步操作选择需要的仪器,注意容量瓶的选用,需要选用250mL的容量瓶.
解答 解:配制250mL溶液,需要选用250mL的容量瓶.
配制一定物质的量浓度NaOH溶液步骤为:计算、称量、溶解、移液、洗涤、定容、摇匀等,一般用①托盘天平称量,用⑦药匙取药品,放在③小烧杯中称量,然后在烧杯中溶解(可用②量筒量取水),冷却后转移到⑧250mL的容量瓶中,并用④玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用⑨胶头滴管滴加,
所以需要的仪器为:①(②)③④⑦⑧⑨,
故选C.
点评 本题主要考查了配制一定物质的量浓度NaOH溶液所需的仪器,要求学生熟练掌握配制一定物质的量浓度的溶液的步骤及仪器的选用方法,本题难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 反应物的总能量低于生成物的总能量时,该反应一定不能发生 | |
| B. | 强酸跟强碱反应放出的热量一定是中和热 | |
| C. | 由反应C(金刚石,s)═C(石墨,s)△H<0,可知石墨比金刚石稳定 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应在常温下一定都能发生 | |
| B. | 等质量的石墨与金刚石完全燃烧,金刚石放出的热量多 | |
| C. | 放热反应中,反应物的总能量大于生成物的总能量 | |
| D. | 石墨比金刚石稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
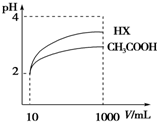 25℃时,电离平衡常数:
25℃时,电离平衡常数:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液化天然气(LNG)和罐装液化石油气(LPG)主要成分都属于烃类 | |
| B. | 煤经过干馏可以得到焦炭和煤焦油等产品,分馏煤焦油可以获得多种芳香烃 | |
| C. | 石油裂化的主要目的是提高轻质液体燃料的产量和质量 | |
| D. | 石油的分馏、煤的液化、煤的气化属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
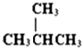 和
和 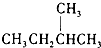 J、
J、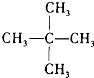 和
和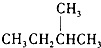
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com