
分析 (2)④步骤VI中氯气将溴离子氧化成溴单质;为验证溴的氧化性强于碘,需要用溴单质氧化碘离子,然后用淀粉检验是否生成碘单质;
⑤氯气能够氧化碘离子,需要排除氯气的干扰;
⑥根据元素周期律知识中同主族元素的非金属性递变规律进行解答.
解答 解:(2)④氯气氧化性大于溴单质,氯气将溴离子氧化成溴单质,反应的离子方程式为:Cl2+2Br-=Br2+2Cl-;将VI所得黄色溶液滴入II所得滤液中,溶液变黄色,然后滴入淀粉溶液,溶液变蓝,说明溴单质将碘离子氧化成了碘单质,证明溴的氧化性大于碘单质,
故答案为:Cl2+2Br-=Br2+2Cl-;将VI所得黄色溶液滴入II所得滤液中;淀粉溶液;
⑤氯气能够氧化碘离子,所以通过步骤ⅥⅠ向其中一支试管中继续滴加新制氯水,直至溶液变为棕红色,证明步骤VI中氯气不足,排除了氯气对溴置换碘实验的干扰,
故答案为:确认VI所得黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰;
⑥根据元素周期律知识可知:同主族元素从上到下,电子层数依次增大,则原子半径逐渐增大,得电子能力逐渐减弱,非金属性减弱,
故答案为:电子层数依次增大,则原子半径逐渐增大.
点评 本题考查了卤素单质的性质及检验方法,题目难度中等,明确化学实验基本操作方法为解答关键,注意掌握卤素单质氧化性强弱及验证方法,试题培养了学生的分析能力及化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 元素 | A | B | C | D |
| 相关的原子结构与性质 | 元素符号为At,与稀有气体元素相邻,但半径比I大 | 其在周期表的周期数和族序数比K的均大1 | 元素符号为Tl,名称是铊,原子核外有六个电子层,与Al同主族 | 可形成双原子分子,分子内有叁键 |
| A. | 元素A的单质可能是一种有色的固体物质,其氢化物HAt易溶于水,很稳定 | |
| B. | 常温下B的单质能与冷水发生剧烈反应,其硫酸盐可能易溶于水 | |
| C. | 铊氧化物化学式为Tl2O3,是离子化合物,Tl2O3和Tl(OH)3均是两性的物质 | |
| D. | 元素D的一些氧化物在大气中会产生光化学烟雾,还会破坏臭氧层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水蒸发制海盐的过程中只发生了物理变化 | |
| B. | 加入明矾,使海水的盐分沉淀并淡化 | |
| C. | 海水淡化的方法主要有蒸馏法、离子交换法和电渗析法等 | |
| D. | 大海中含有钾、溴、碘等元素,需经过氧化还原反应才可得到钾、溴、碘的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
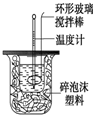 利用右图装置测定中和热的实验步骤如下:
利用右图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温 度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4℃ |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑥⑨⑩ | B. | ①③④⑦⑧⑨⑩ | C. | ①②③④⑦⑧⑨ | D. | ①②④⑤⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1体积NO | B. | 1体积NO2和$\frac{1}{2}$体积O2 | ||
| C. | $\frac{1}{4}$体积O2 | D. | $\frac{1}{3}$体积NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
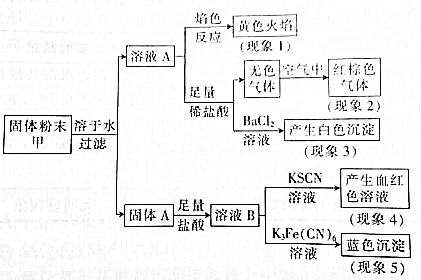
| A. | 根据现象1可推出该固体粉末中含有钠元素,可能含钾元素 | |
| B. | 根据现象2可推出该固体粉末中一定含有NaNO3 | |
| C. | 根据现象3可推出该固体粉末中一定含有Na2SO4 | |
| D. | 根据现象4和现象5可推出该固体粉末中一定含有FeO和Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H6和C5H10 | B. | C4H10和C8H18 | C. | CH2=CH2与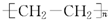 | D. | C4H6和C6H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
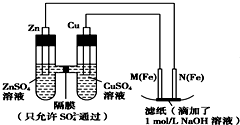
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com