
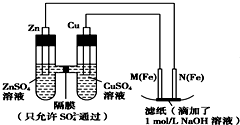
分析 根据图知,该装置中左边的电极能自发的进行氧化还原反应,为原电池,右边的装置为电解池,Zn易失电子作负极、Cu作正极,则连接Cu的电极M为阳极、连接Zn的电极N为阴极;
(1)Cu作正极,能代替Cu作电极的电极材料应该不如Cu活泼且能导电;
(2)N电极上水得电子生成氢气同时生成氢氧根离子;
(3)原电池中,电解质溶液中阴离子向负极移动,阳离子向正极移动;
M电极上Fe失电子生成Fe 2+,Fe 2+和OH-反应生成白色Fe(OH)2沉淀,Fe(OH)2不稳定,被空气中氧气氧化生成红褐色的Fe(OH)3;
(4)电池反应式知,Zn元素化合价由0价变为+2价、Fe元素化合价由+6价变为+3价,则负极上Zn失电子发生氧化反应,正极上FeO42 -得电子发生还原反应.
解答 解:根据图知,该装置中左边的电极能自发的进行氧化还原反应,为原电池,右边的装置为电解池,Zn易失电子作负极、Cu作正极,则连接Cu的电极M为阳极、连接Zn的电极N为阴极;
(1)Cu作正极,能代替Cu作电极的电极材料应该不如Cu活泼且能导电,Mg、Al活泼性大于Cu,玻璃棒不导电,则符合条件的只有石墨,故答案为:C;
(2)N电极上水得电子生成氢气同时生成氢氧根离子,电极反应式为2H2O+2e-=H2↑+OH-,
故答案为:2H2O+2e-=H2↑+OH-;
(3)原电池中,电解质溶液中阴离子向负极移动,阳离子向正极移动,则硫酸根离子从右向左移动;
M电极上Fe失电子生成Fe 2+,Fe 2+和OH-反应生成白色Fe(OH)2沉淀,Fe(OH)2不稳定,被空气中氧气氧化生成红褐色的Fe(OH)3,滤纸上看到的现象是滤纸上有红褐色斑点产生,发生的反应为4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:从右向左;滤纸上有红褐色斑点产生;4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(4)电池反应式知,Zn元素化合价由0价变为+2价、Fe元素化合价由+6价变为+3价,则负极上Zn失电子发生氧化反应,正极上FeO42 -得电子发生还原反应,电极反应式为2 FeO42 -+6e -+5H2 O=Fe 2 O 3+10OH-,
故答案为:2 FeO42 -+6e -+5H2 O=Fe 2 O 3+10OH-.
点评 本题考查原电池和电解池原理,为高频考点,正确判断正负极、阴阳极及各个电极上发生的反应是解本题关键,涉及电极反应式的书写、氧化还原反应、电极材料的判断等知识点,难点是电极反应式的书写,题目难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子的比例模型: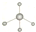 | B. | 苯的最简式:CH | ||
| C. | 乙烯的分子式:CH2=CH2 | D. | 乙醇的结构简式:C2H6O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 和
和  J、
J、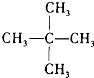 和
和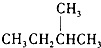
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
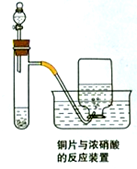 如图为铜片与浓硝酸反应的装置示意图,据图回答下列问题:
如图为铜片与浓硝酸反应的装置示意图,据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇的作用是为了在微热下溶解牛油 | |
| B. | 加入氢氧化钠溶液,边搅拌边小心加热,反应液逐渐变成黄棕色黏稠状 | |
| C. | 蘸取反应液,滴入热水中,若无油滴浮在液面上说明已完全反应 | |
| D. | 完全反应后,加入热的饱和食盐水,有固体析出,固体沉于液面下 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氨水中通入足量二氧化碳:NH3•H2O+CO2═NH4++HCO3- | |
| B. | 铜片与浓硝酸反应:Cu+NO3-+4H+═Cu2++NO2↑+2H2O | |
| C. | 氯化铵浓溶液跟NaOH浓溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3•H2O | |
| D. | 84消毒液具有消毒性的原理为:2ClO-+CO2+H2O=2HClO+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com