
【题目】A、B、C三种常见单质,其中A、C为气体,B为常见金属.A溶于水所得的溶液可使紫色石蕊先变红后褪色.F的水溶液为浅绿色,其转化关系如图所示,请回答: 
(1)A和C燃烧的现象是 .
(2)F的化学式是 , 检验F水溶液中金属阳离子的方法 .
(3)反应②的离子方程式是
【答案】
(1)安静地燃烧、产生苍白色火焰、瓶口有白雾
(2)FeCl2;先加入KSCN溶液,无明显现象,再加入几滴新制氯水,溶液变成血红色,可说明存在亚铁离子
(3)2Fe2++Cl2═2Fe3++2Cl﹣
【解析】解:A溶于水所得的溶液可使石蕊试液先变红后退色,则说明A为Cl2 , 氯气与水反应生成HCl和HClO,能使石蕊试液先变红后褪色;F的水溶液为浅绿色溶液,说明F中含有Fe2+ , 能继续和Cl2反应生成D,则D为FeCl3 , F为FeCl2 , 所以B为Fe,则C为H2 , E为HCl,(1)A为氯气,C为氢气,氢气在氯气中燃烧:H2+Cl2 ![]() 2HCl,生成的氯化氢气体极易溶于水,所以瓶口上方有白雾,所以燃烧的现象为:安静地燃烧、产生苍白色火焰、瓶口有白雾,所以答案是:安静地燃烧、产生苍白色火焰、瓶口有白雾;(2)F为FeCl2 , 检验亚铁离子的方法为:先加入KSCN溶液,无明显现象,再加入几滴新制氯水,溶液变成血红色,可说明存在亚铁离子,
2HCl,生成的氯化氢气体极易溶于水,所以瓶口上方有白雾,所以燃烧的现象为:安静地燃烧、产生苍白色火焰、瓶口有白雾,所以答案是:安静地燃烧、产生苍白色火焰、瓶口有白雾;(2)F为FeCl2 , 检验亚铁离子的方法为:先加入KSCN溶液,无明显现象,再加入几滴新制氯水,溶液变成血红色,可说明存在亚铁离子,
所以答案是:FeCl2;先加入KSCN溶液,无明显现象,再加入几滴新制氯水,溶液变成血红色,可说明存在亚铁离子;(3)②FeCl2具有还原性,能与具有氧化性的Cl2反应生成FeCl3 , 反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl﹣ ,
所以答案是:2Fe2++Cl2═2Fe3++2Cl﹣ .


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G七种短周期元素的原子序数依次增大.其中仅有一种稀有气体元素.A和E最外层电子数相同,短周期主族元素的原子中,E原子的半径最大;B、C和F 在周期表中相邻,B、C同周期,C、F同主族,F原子的质子数是C原子质子数的2倍;A和C可形成两种常见的液态化合物X和Y(相对分子质量X<Y );D形成的分子为单原子分子.回答问题:
(1)Y的电子式为 .
(2)液态化合物Y与稀硫酸酸化的K2Cr2O7溶液作用可产生一种无色助燃气体及可溶性的Cr2(SO4)3 , 则该反应的离子方程式为 .
(3)用某种金属易拉罐与A、C、E组成的化合物的水溶液反应.产生的气体可充填气球,请写出该反应的离子方程式 , 使用这种气球存在的隐患是 .
(4)P和Q两种物质都是由A、C、E、F四种元素组成的盐,其水溶液都显酸性,等物质的量的P和Q恰好完全反应.写出该反应的离子方程式: , 这两种盐均含有的化学键类型为 .
(5)由A、B两元素形成的化合物W可作为火箭推进器中的强还原剂,已知一个W分子和一个Y分子中都含有18个电子,1mol液态W和2mol液态Y恰好完全反应.写出该反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图示的转化关系,已知C为密度最小的气体,甲是电解质。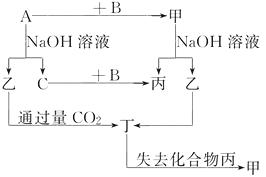
根据图示转化关系回答:
(1)写出下列物质的化学式:
A , B , 乙 , 丁。
(2)组成单质A的元素在周期表中的位置是 , 丙的电子式是。
(3)写出下列变化的方程式:
①A与NaOH溶液反应的化学方程式。
②乙与过量CO2反应的离子方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为保护环境、缓解能源危机.有些城市开始尝试用乙醇(C2H5OH)代替汽油作汽车燃料。乙醇的官能团是( )
A. —CH3 B. —COOH C. —OH D. H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.石油裂解、石油分馏、煤的干馏都是化学变化
B.包装用材料聚乙烯和聚氯乙烯都属于烃
C.在一定条件下,苯和液溴、硝酸作用生成溴苯、硝基苯都属于取代反应
D.苯和甲苯都不属于芳香烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铷(Rb)的叙述正确的是
A. 它位于周期表的第四周期、第ⅠA族B. 在钠、钾、铷3种单质中,铷的熔点最高
C. 氢氧化铷是弱碱D. 硝酸铷是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设计了如图所示实验,以确认某混合气体中含有C2H4和SO2 . 混合气体,所需试剂有:
A.品红溶液 B.NaOH溶液
C.浓H2SO4 D.酸性高锰酸钾溶液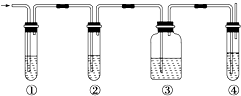
试回答下列问题:
(1)写出图中①、②、③、④装置可盛放的试剂(将上述有关试剂的序号填入空格内): ① , ② , ③ , ④ .
(2)使用装置②的目的是 .
(3)写出SO2与酸性高锰酸钾反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:。
(2)写出“联合制碱法”有关反应的化学方程式:。
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应列出计原子利用率的表达式:原子利用率(%)?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com