
某课题组进行实验研究时,欲配制浓度均为1.0mol•L-1 的Ba(OH)2和H2SO4溶液。
Ⅰ.该组同学在配制Ba(OH)2溶液时,只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(相对分子质量:315),发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。
(1)用化学方程式解释未溶物产生的原因
(2)某同学查得Ba(OH)2·8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6。据此认为即便使用纯净的Ba(OH)2·8H2O,在室温下也不能配得1.0 mol•L-1Ba(OH)2溶液,其理由是:
Ⅱ.用18 mol•L-1的浓硫酸配制450 mL 1.0 mol•L-1稀硫酸。
(3)实验时,需量取浓硫酸的体积为 mL,需用的主要仪器有量筒、烧杯、玻璃棒、 、
(4)配制溶液时,定容的操作方法是 :
(5)实验中下列情况会使所配溶液浓度偏高的是
A.洗涤量取浓硫酸的量筒2~3次,并将洗涤液转入容量瓶中
B.定容时仰视刻度线
C.振荡摇匀后再重新加水至刻度线
D.用水洗涤容量瓶未干燥
(1)Ba(OH)2+CO2 =BaCO3+H2O(2分)
(2)室温下,Ba(OH)2饱和溶液的浓度只约为0.12 mol•L-1 (2分)
(3) 27.8(2分),胶头滴管、500 mL容量瓶(2分)
(4)加水离刻度线1~2 cm,改用胶头滴管逐滴滴加至刻度线(2分)
(5) A (2分)
【解析】
试题分析:(1)长期放在空气中氢氧化钡会与二氧化碳反应生成碳酸钡而出现浑浊。(2)室温下,溶解度为3.9g/100g水。n=.9g/315g/mol=0.012mol 10000g水中应该溶解0.12mol,假设密度是1g/ml,所以浓度大约0.12mol/L,达不到1mol/L。(3)只能用500ml的容量瓶配置无450ml的容量瓶。所需主要仪器有量筒、烧杯、玻璃棒、胶头滴管、500 mL容量瓶.(4) 定容的操作方法是加水离刻度线1~2 cm,改用胶头滴管逐滴滴加至凹液面与刻度线相切。(5)量取浓硫酸的量筒不需要洗涤,制备量筒时误差已经考虑,否则溶质偏多结果偏高。仰视刻度线使加水多,所以浓度偏低。洗涤容量瓶没有干燥无影响。
考点:本题考查配置溶液时的具体操作和有关浓度的计算问题。


科目:高中化学 来源: 题型:阅读理解
 (2012?安徽)工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.
(2012?安徽)工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.| [SO42-] |
| [CO32-] |
| [SO42-] |
| [CO32-] |
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取一定量样品充分干燥,… |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验步骤(不要求具体的操作过程) | 预期实验现象和结论 |
| 取少量黑色固体, |
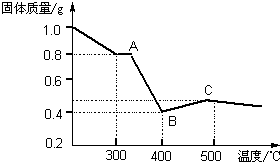 [定量研究]课题组在文献中查阅到,FeC2O4?2H2O受热分解时,固体质量随温度变化的曲线如图所示,写出加热到400℃时,FeC2O4?2H2O晶体受热分解的化学方程式为:
[定量研究]课题组在文献中查阅到,FeC2O4?2H2O受热分解时,固体质量随温度变化的曲线如图所示,写出加热到400℃时,FeC2O4?2H2O晶体受热分解的化学方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省高三年级第一次联考理综化学试卷(解析版) 题型:实验题
草酸亚铁晶体(FeC2O4·2H2O)呈淡黄色。某课题组为探究草酸业铁晶体的化学性质, 进行了一系列实验探究。
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成。这说明草酸亚铁晶体具有 (填“氧化性”、“还原性”或“碱性”)。若反应中消耗1 mol FeC2O4·2H2O,则参加反应的KMnO4为 mol。
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体。课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO
假设二:
假设三:
(3)为验证上述假设一是否成立,课题组进行如下研究。
【定性研究】请你完成下表中内容。
|
实验步骤(不要求写出具体操作过程) |
预期实验现象和结论 |
|
取少量黑色固体,
|
|
【定量研究】课题组在文献中查阅到,FeC2O4·2H2O受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,FeC2O4·2H2O晶体受热分解的化学方程式为: 。

根据图象,如有1.0 g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4 g。某同学由此得出结论:假设一不成立。你是否同意该同学的结论,并简述理由:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com