
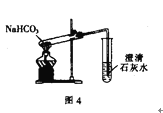
【题目】用下列实验装置进行相应的实验,能达到实验目的的是( )
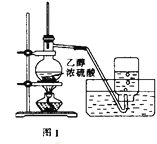


A. 利用图1装置制备乙烯
B. 利用图2装置除去Cl2中的HCl
C. 利用图3装置证明酸性强弱:盐酸>H2CO3>醋酸
D. 利用图4装置探究NaHCO3的热稳定性
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】一般较强酸可制取较弱酸,这是复分解反应的规律之一。已知20℃时:K(C6H5OH)=1.2×10-10、K(CH3COOH)=1.8×10-5、K(H2CO3)=4.3×10-7、K(HCO3-)=5.6×10-11、K(HCN)=4.9×10-10。
(1)请根据上述信息求Na2CO3+C6H5OH![]() NaHCO3+C6H5ONa的化学平衡常数K=__________;
NaHCO3+C6H5ONa的化学平衡常数K=__________;
(2)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9molL-1,则该电解质可能是_________(填序号);
A.CuSO4 B.HCl C.Na2S D.NaOH E.K2SO4
(3)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性。①浓度为1.0×l0-3mol·L-1的氨水b L;②c(OH-)=1.0×10-3mol·L-1的氨水c L;③c(OH-)=1.0×10-3molL-1的氢氧化钡溶液d L。则a、b、c、d之间由大到小的关系是_________;
(4)室温时,向0.2molL-1的醋酸溶液中加入等体积的0.1molL-1的NaOH(aq),充分反应后所得溶液的pH=4,则所得溶液中各离子浓度大小关系是________________,所得溶液中的物料守恒式为:________+________=__________=_________ molL-1,所得溶液中c(CH3COOH)=____________________molL-1(写出算式,不做计算);
(5)已知常温时Ksp(AgCl)=1.8×10-10mol2L-2,向50mL 0.018molL-1的AgNO3溶液中加入相同体积0.020molL-1的盐酸,则c(Ag+)=_______________,此时所得混合溶液的pH=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是一个简易测量物质反应是吸热反应还是放热反应的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应。将镁片加入小试管内,然后注入足量的盐酸,请根据要求完成下列问题:
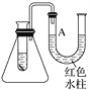
(1)有关反应的离子方程式是_________________________________________,
试管中看到的现象是________________________________________。
(2)U形管中液面A________(填“上升”或“下降”),原因是__________________;
说明此反应是________(填“放热”或“吸热”)反应。
(3)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用盐酸标准液滴定未知浓度的NaOH溶液,下列各操作中会引起实验误差的是( )
A. 滴定前酸式滴定管需用盐酸标准液润洗
B. 用蒸馏水洗净锥形瓶后,立即装入一定体积的NaOH溶液后进行滴定
C. 往盛有20.00 mL NaOH溶液的锥形瓶中,滴入几滴酚酞指示剂后进行滴定
D. 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,然后装入一定体积的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是分离混合物时常用的仪器,回答下列问题:

(1)写出仪器A、E的名称____、____。
(2)若向C装置中加入碘水和少量CCl4,振荡后静置,会观察到什么现象?____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素在生物体内的含量分布情况,下列表述不正确的是( )
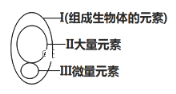
A. Ⅰ在非生物界中都能找到,体现了生物界与非生物界的统一性
B. Ⅲ含量虽少,却是生物体正常生命活动不可缺少的
C. Ⅱ和Ⅲ为生物体的必需元素,一旦缺乏就可能会导致相应的病症
D. P、S、K、Ca、Zn属于大量元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(物质结构与性质)N、O、S、Cl、Cu五种元素的单质及其化合物在现代工业生产中有着广泛应用。请回答下列问题:
(1)第一电离能:N__________(填“>”或“<”,下同)O,电负性:S__________Cl。
(2)H2O的沸点比H2S高的原因是________________________;SO3属于__________(填“极性”或“非极性”)分子,1molSO2Cl2含有π的键为__________mol。
(3)SO3的空间构型是__________,NH4+的中心原子的杂化方式为__________。
(4)与NO3-互为等电子体的微粒有__________(任写两种)。
(5)Cu与Cl形成化合物的晶胞如图所示。
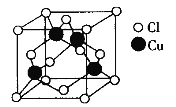
该晶体的化学式为__________。已知该晶体中Cu原子和Cl原子之间的最短距离为acm,且恰好为体对角线的1/4,阿伏加德罗常数为NA,则该晶体的密度为__________(只写计算式)g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验装置的科学设计是实验是否取得预期效果的关键。请回答下列有关实验装置的相关问题:

I.图A为教材制备乙酸乙酯的实验装置,甲同学认为图B装置比A要好,则冷却水应从_______口进入;乙同学认为图C装置效果更好,理由是________________。
Ⅱ.“摩尔盐”[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂。已知:摩尔盐隔绝空气加热至500℃时可完全分解。某学习小组欲探究其分解产物。
(1)(提出猜想)小组同学认为分解产物可能有以下几种情况:
A.Fe2O3SO2NH3H2O B.FeO SO3NH3H2O
C.FeO SO2NH3H2O D.Fe2O3SO3SO2NH3H2O
根据所学知识,可确定______________不成立(填序号)
(2)(药品验纯)甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和__________溶液检验出“摩尔盐”中的三种离子;取一定量的“摩尔盐”配成溶液,取少量溶液置于试管中,向其中滴加______________(填试剂名称和实验现象),则“摩尔盐”未因氧化而变质。
(3)(实验探究)为检验分解产物,甲同学设计了如下实验装置。

①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是__________。
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀。C中发生反应的离子方程式为_____。
③实验验证取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含_______。
(4)(实验结论与反思)通过实验现象和认真反思,上述猜想中一定正确的是_________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙三分子中含相同数目的质子数,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如下图所示:

(1)写出B+乙―→甲+C的化学反应方程式___________________________
(2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是________。(填写序号) ①A ②B ③C ④D
(3)依据下列条件可以进一步确定上述第四种元素:①甲与丙以及乙与丙均能够发生反应,②甲、丙都是无色、有刺激性气味的物质。
据此,请回答下列问题:写出上述第四种元素在周期表中第_______周期第_______族;写出C+丙―→乙+丁的化学反应方程式_________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com