
【题目】下图为元素在生物体内的含量分布情况,下列表述不正确的是( )
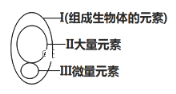
A. Ⅰ在非生物界中都能找到,体现了生物界与非生物界的统一性
B. Ⅲ含量虽少,却是生物体正常生命活动不可缺少的
C. Ⅱ和Ⅲ为生物体的必需元素,一旦缺乏就可能会导致相应的病症
D. P、S、K、Ca、Zn属于大量元素
【答案】D
【解析】
本题旨在考查生物体内的元素相关知识,细胞中常见的化学元素有20多种,其中有些含量较多,如C、H、0、N、P、S、K、Ca、Mg等,称为大量元素;有些含量很少,如Fe、Mn、Zn、Cu、B、Mo等,被称为微量元素。组成细胞的元素都是正常生命活动需要的。
组成生物体的化学元素,在无机自然界中都能够找到,没有一种化学元素为生物体所特有,体现了生物界与非生物界的统一性,A正确;微量元素含量虽少,却是生物体正常生命活动不可缺少的,B正确;组成细胞的元素都是正常生命活动需要的,一旦缺乏就可能会导致相应的病症,C正确;P、S、K、Ca属于大量元素,Zn属微量元素,D错误;故错误的选D。


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】用电石(CaC2)制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量, 从而计算电石(CaC2)的纯度。
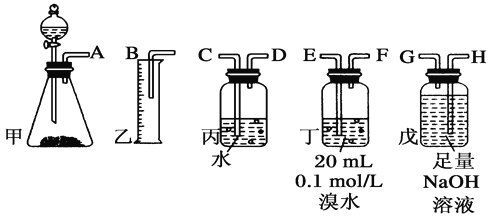
(1)完成甲装置发生的化学反应方程式______________。
(2)进行实验时,所制气体从左向右流,仪器的正确连接顺序是____________________(填接口字母);
(3)为了使实验中气流平稳,甲中分液漏斗里的液体X通常用____________________;
(4)若在标准状况下溴水与乙炔完全反应生成C2H2Br4,已知称取电石m g,测得量筒内液体体积V mL,则电石纯度可表示为____________________;
(5)若没有除H2S的装置,测定结果将会________(填“偏高”、“偏低”或“不变”),理由是_________________________________ (用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝具有较强的抗腐蚀能力(即耐腐蚀)的主要原因是
A. 铝化学性质很稳定(即很不活泼) B. 铝与氧气在常温下很难反应
C. 铝是两性元素(因与酸、碱都能反应) D. 铝易氧化形成一层致密氧化膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g) ![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(KⅠ):
温度 | 250 ℃ | 300 ℃ | 350 ℃ |
KⅠ | 2.0 | 0.27 | 0.012 |
(1)在一定条件下将2 mol CO和6 mol H2充入2 L的密闭容器中发生反应Ⅰ,5 min后测得c(CO)=0.4 mol·L-1,计算可得此段时间的反应速率(用H2表示)为________mol·L-1·min-1。
(2)由表中数据判断ΔH1______(填“>”“<”或“=”)0;反应CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH3=_________(用ΔH1和ΔH2表示)。
CO(g)+H2O(g) ΔH3=_________(用ΔH1和ΔH2表示)。
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是______(填序号)。
a.充入CO,使体系总压强增大
b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大
d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:KⅡ=__________________;保持恒温恒容,将反应Ⅱ的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡_______(填“正向”“逆向”或“不”)移动,平衡常数KⅡ__________(填“变大”“变小”或“不变”)。
(5)比较这两种合成甲醇的方法,原子利用率较高的是______(填“Ⅰ”或“Ⅱ”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,11.2L HF 中含有氟原子的数目为0.5 NA
B. 2 mol SO2 和1mol O2 混合充分反应后,转移电子的数目为4 NA
C. 46g NO2 和N2O4的混合物中含有氧原子的数目为2 NA
D. 1mol 乙醇分子中含有极性键的数目为8 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子,下列说法正确的是 ( )
A. X元素原子基态时的电子排布式为[Ar]4s24p3
B. X元素是第四周期第ⅤA族元素
C. Y元素原子的电子排布图为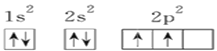
D. Z元素具有两性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. MnO2与浓盐酸混合加热:MnO2+4H++2Cl﹣![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B. 大理石与盐酸反应:CO32﹣+2H+ = H2O+CO2↑
C. 向醋酸溶液中滴加NaOH溶液:OH-+H+![]() H2O
H2O
D. 漂白粉溶液吸收二氧化碳:Ca2++ CO2+ H2O = CaCO3↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5。
则下列有关比较中正确的是( )
A. 电负性:④>③>②>① B. 原子半径:④>③>②>①
C. 第一电离能:④>③>②>① D. 最高正化合价:④>③=②>①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com