
| A、①④ | B、①③ |
| C、①②③ | D、①②③④ |


科目:高中化学 来源: 题型:
| A、向Ba(OH)2稀溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42+NH4+═BaSO4↓+NH3?H2O+H2O |
| B、在碳酸氢钠溶液中加入过量的氢氧化钡溶液:Ba2++OH-+HCO3-═BaCO3↓+H2O |
| C、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
| D、FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
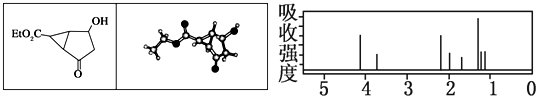
| A、右图中最强吸收峰与最弱吸收峰高度比为3:2 |
| B、该有机物分子中含有4个手性碳原子 |
| C、键线式中的Et代表的基团为-CH3 |
| D、该有机物在一定条件下能够发生消去反应和取代反应,但不能发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大该体系的压强,平衡不移动,化学平衡常数不变 |
| B、反应速率v(Y)=0.15 mol/(L?min) |
| C、Y的平衡转化率为60% |
| D、增加X,平衡向右移动,X的平衡转化率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳具有还原性,高温条件下能将二氧化硅还原为硅 |
| B、二氧化硫有漂白、杀菌性能,可在食品加工中大量使用 |
| C、二氧化硅是半导体材料,可将太阳能直接转化为电能 |
| D、二氧化锰具有较强的氧化性,可作H2O2分解的氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com